Анна (дочь пациентки): «Моя мама до этого перенесла две неудачные операции в Москве по пластике мочеточника. Обе операции делали профессора. Несмотря на якобы бесплатную медицину в России, мы «отнесли» очень много денег. Но проблема не разрешилась, мама чахла на глазах, анализы ухудшались.
Единственным выходом казалась ампутация почки. Но и это не было бы адекватным решением, так как во второй почке присутствуют кисты. Мы не знали, что нам делать, пока очередной профессор не сказал: «Уезжайте на лечение за границу, вам тут не помогут».
Суть операции
На данный момент в клинической практике используются несколько способов проведения операции на мочеточнике:
- выкраивание лоскута из тканей мочевого пузыря;
- использование тканей кишечника для замены поврежденного участка.
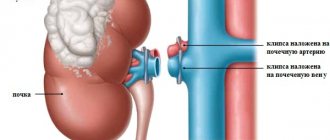
Операция проводится под эндотрахеальным наркозом. На предварительно подготовленном операционном поле хирург иссекает участок кишки или стенки мочевого пузыря, сохраняя на нем сосуды, ответственные за кровоснабжение.
Полученный лоскут обрабатывается дезинфицирующими веществами, после чего в него вводится трубка. После удаления поврежденного мочеточника новый сформированный орган располагают на его месте.
В некоторых случаях трансплантат может вшиваться в мочевой пузырь, который будет подвержен резекции в этом участке.
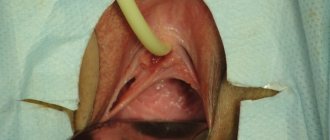
Пластика при гипоспадии
Кишечная пластика представляет собой фронт работ по формированию части мочевыводящего пути из изолированного сегмента кишечника, в частности, используется тонкий кишечник. В ходе работы хирург с помощью катетера формирует из сегмента кишки мочеточник нужного размера и сшивает его с чашечно-лоханочной системой почки и мочевым пузырем. Данная методика используется при необходимости полной замены поврежденного участка.
При частичной пластике используется все тот же отрезок изолированной кишки и сшивается с оставшимися здоровыми частями мочеточника. При этом катетер, используемый в ходе процедуры, выводится наружу. Он будет служить временным мочеточником, пока не наступит полное заживление всех тканей. Частичная пластика позволяет устранить опухоли или спаечные процессы на небольших участках. Также данное вмешательство используют и для устранения больших по площади повреждений мочеточника.
При гипоспадии в легкой форме хирургическое вмешательство не назначается. Операция требуется при:
- тяжелой дистонии;
- искривлении ствола полового члена;
- дисфункция мочевыделительной системы.
Основная задача лечения – это исправление внешнего вида органа, приведение наружной части уретры в правильное анатомическое положение.
Специалисты выделяют несколько типов гипоспадии:
- головчатая — отверстие расположено не по центру, а ближе к краю;
- венечная — выход расположен в венечной борозде;
- пенильная или стволовая — локализуется на теле пениса, чаще по нижней стороне;
- мошоночная — в области мошонки;
- промежностная — между анальным отверстием и мошонкой;
- скрытая гипоспадия — отверстие локализовано по центру, но ввиду недоразвитого (укороченного) мочеиспускательного канала пенис искривлен.
ПОДРОБНОСТИ: Подготовка к операции мочевого пузыря
Пластика при такой патологии осуществляется при помощи трансплантации ткани, которая берется из крайней плоти или мошонки пациента. Если материала не хватает, то дополнительная ткань берется из слизистой оболочки мочевого пузыря или ротовой полости.
В процессе операции половой орган должен пребывать в продолжительной эрекции. Для этого врачи используют специальный жгут, который накладывается на основание пениса, а в его тело вводится специальная жидкость. Это абсолютно безопасно, поскольку врачи следят за состоянием и осуществляют все необходимые действия по обеспечению кровоснабжения пениса.
Второй этап операции заключается в реконструировании мочеиспускательного канала. Коррекция выполняется при помощи лоскутов. В конце операции мочевой пузырь наполняют окрашенной жидкостью, надавливают на него и следят за правильным прохождением жидкости по мочеточнику.
Показания
При отсутствии желаемого терапевтического эффекта от консервативной терапии и невозможности восстановить функционирование мочеточника назначается проведение пластической операции. Основными показаниями к ней являются:
- гидронефроз (расширение почечной лоханки и чашек);
- гидроуретеронефроз, развившийся на фоне образования стриктур (один из видов органических повреждений мочеточника);
- ранее перенесенные повреждения почки или мочеточника, связанные с травмами или гинекологическими оперативными вмешательствами;
- обструкции мочевых путей, обусловленные различными патологиями и послеродовыми осложнениями (нарушения, препятствующие оттоку мочи).
Гидронефроз
ТАКТИКА ЛЕЧЕНИЯ ГИДРОНЕФРОЗА У ДЕТЕЙ МЛАДШЕГО ВОЗРАСТА
Гидронефроз (Обструкция пиелоуретерального сегмента) – это расширение коллекторной системы почки (лоханки и чашечек) в результате нарушения пассажа мочи в прилоханочном отделе мочеточника. Суть порока в нарушении проходимости мочи из лоханки в мочеточник.
Признаки сужения прилоханочного отдела мочеточника могут выявляться у детей во всех возрастных группах. В настоящее время с развитием ультразвуковой диагностики и проведением мониторинга состояния плода на ранних стадиях беременности удается выявлять данную патологию еще внутри утробно. По данным Colodny (1980) обструкция пиелоуретрального сегмента составляет до 80% от всех аномалий фетальной почки сопровождающихся расширением коллекторной системы. Расширение лоханки и чашечек на ранних стадиях беременности наблюдается довольно часто у 1:800 плодов. К моменту родов расширение чашечно-лоханочной системы (ЧЛС) выявляют в два раза реже у 1:1500 новорожденных (M.Ritchey 2003). Однако диагноз гидронефроз подтверждается только у трети из этих детей. В отдельных случаях сужение прилоханочного отдела мочеточника может возникать в пубертатном периоде или во взрослом возрасте. Причиной гидронефроза у подобных больных обычно бывает сдавление мочеточника дополнительным сосудом, идущим к нижнему полюсу почки Препятствие току мочи может быть не постоянным (перемежающийся гидронефроз) и зависеть от положения тела больного. За счет смещения почки вниз в положении стоя Marshall (1984).
Обструкция в пиелоуретеральном сегменте в два раза чаще наблюдается у мальчиков, особенно при выявлении патологии в периоде новорожденности Robson (1977). Доминирует левостороннее поражение почки, в неонатальном периоде гидронефроз слева встречается 66% больных. Двусторонний стеноз прилоханочного отдела мочеточника наблюдается в 5-15% случаев Williams (1977).
Причины возникновения гидронефроза:
А. Сужение мочеточника за счет уменьшения внутреннего просвета ( Intrinsic) (сегментарная дисплазия,вр.стеноз) (Рис.1).
Б. Сдавление просвета мочеточника снаружи (Extrinsic) пересекающим сосудом, добавочным или нижнеполярным сосудом почки (Рис.2), опухолью, инфильтратом (воспалительный процесс в забрюшинном пространстве)
В. Вторичный — нарушение проходимости в пиелоуретральном сегменте при ПМР (пузырно-мочеточниковом рефлюксе- обратном забросе мочи в почку); МКБ-мочекаменной болезни (длительное воздействие камня); травматическом повреждении –надрыв слизистой или стенки мочеточника;
Рис.1 Сужение мочеточника за счет уменьшения внутреннего просвета (Intrinsic)
Б. Stephens (1980) выявил клапанообразные поперечные складки слизистой оболочки мочеточника препятствующие пассажу мочи.
Рис.2. Сдавление мочеточника абберантным (отклоненным) сосудом
В последнее десятилетие отмечается значительный прогресс в лечении гидронефроза, однако дети младшего возраста составляют наиболее сложную группу этих больных. Широко обсуждаются показания к операции, оптимальный возраст и метод хирургического вмешательства, показания к удалению гидронефротической почки.
Показания к операции
Отсутствует прямая связь величины расширения ЧЛС и степени сужения прилоханочного отдела мочеточника. Сохраненная сократительная способность лоханки, позволяет долгое время обеспечивать эвакуацию мочи через суженный участок мочеточника. Провакационные пробы с диуретической нагрузкой позволяют определить особенности эвакуации мочи из лоханки при увеличенном объеме выделения мочи.
Поэтому показания к оперативному лечению в настоящее время выставляют на основании не только больших размеров лоханки, но и доказанных (специальными обследованиями) признаков обструкции (сужения) в прилоханочном отделе мочеточника.
Наиболее распространенным диагностическим тестом для определения показаний к операции в экономически развитых странах считается радиоизотопное обследование с лазиксной нагрузкой, либо УЗИ с лазиксной нагрузкой.
В настоящее время наиболее информативными методами выявления обструкции пиелоуретрального сегмента считают ультразвуковое исследование, экскреторную урографию и радиоизотопное исследование. УЗИ прекрасный метод скринингового обследования, при котором выявляется расширение лоханки и чашечек у детей любого возраста, в том числе и у новорожденных. У младенцев первых месяцев жизни необходимо проводить дифференциальный диагноз гидронефроза с пиелоэктазией или функциональным расширением ЧЛС, которое исчезает самостоятельно в течении 3-6 мес.
УЗИ с лазиксной нагрузкой позволяет уточнить данный диагноз. Перед исследованием проводится водная нагрузка (в\в капельное введение глюкозы 5% из расчета 15мл\кг веса за 30 мин до исследования). Детей старшего возраста просят опорожнить мочевой пузырь. Грудному ребенку устанавливают уретральный катетер на весь период исследования, чтобы исключить ложноположительный результат, обусловленный переполненным мочевым пузырем. Измеряется поперечный максимальный размер лоханки и чашечек в стандартном положении. Далее вводят лазикс в\в из расчета 0,5-1.0мг/кг. Затем измеряют размеры лоханки и чашечек через 10,20,40,60,120 минут после введения лазикса.
Признаками органической обструкции считают:
- Длительное ( более 60 минут) расширение ЧЛС на (более чем 30% ) от исходного размера на фоне лазикса и адекватной гидратации при сохраненном почечном кровотоке.
- Появление болевого синдрома, тошноты и рвоты свидетельствует в пользу обструкции.
- Уменьшение скорости почечного кровотока и повышение на 15% индекса сопротивления на фоне лазиксной нагрузки.
- Признаки гипертрофии контрлатеральной почки
- В зарубежной литературе для подтверждения диагноза широко используют инфузионную нефросцинтиграфию (радиоизотопное исследование) с технецием 99m диэтилентриаминпентауксусной кислотой (ДТПК) C.Mann (1997).
Применяется следующий протокол исследования. Перед сцинтиграфией проводится внутривенная гидратация из расчета 15мг/кг 5% декстрозы в 33% физиологическом растворе. Не менее 50% общего объема вводят перед инъекцией фуросемида (лазикс). Мочевой пузырь катетеризируют. Технеций 99m ДТПК вводят внутривенно, после чего примерно через 30 мин вводят в/в фуросемид в количестве 1мл/кг. В пользу обструкции свидетельствует сохранение более 50% изотопа в почечной лоханке в течение 20 минут после введения инъекции фуросемида (Рис. 4). Если функция почки нарушена умеренно, показана операция — пиелопластика. О нормальной функции почки можно говорить, по данным сцинтиграфии, если почка обеспечивает более 40% общего поглощения (суммарного вклада). Значения этого показателя от 10 до 40% свидетельствуют об умеренном нарушении функции, а ниже 10% — о тяжелом поражении.
Рис.4. Радиоизотопное обследование с лазиксной нагрузкой. Нормальное выведение изотопа левой почкой. Замедленное выведение радиофармпрепарата правой почкой (через тридцать минут более половины изотопа остается в почке) (BG Cilento 1998).
Если по данным радиоизотопного исследования (сцинтиграфии) почка обеспечивает более 10% общей функции, то целесообразно произвести пиелопластику, а не нефрэктомию C.Mann (1997). В сомнительных случаях выполняют пункционную нефростомию, с последующей оценкой объема, концентрации мочи выделяемой пораженной почкой, изучают динамику кровотока после декомпрессии коллекторной системы.
Хотя ренальная сцинтиграфия с 99m Tc (технецием) дает довольно ценную информацию при обструкции ПУС, иногда желательно определить также глубину поражения кортикального слоя почки и парциальную функцию. Наиболее информативным в этом плане является исследование с изотопом DMSA (dimercaptosuccinic acid).
Урологическое обследование при обструкции пиелоуретрального сегмента (ПУС) должно включать и микционную цистоуретрографию для исключения пузырно-мочеточникового рефлюкса (ПМР). При ПМР высокой степени может возникать расширение почечной лоханки и перегиб пиелоуретрального сегмента. Незначительный пузырно-мочеточниковый рефлюкс иногда сопровождает классическую обструкцию ПУС. D.Ellis (1997) (Рис.5). Традиционная экскреторная урография по данным отечественной литературы остается в настоящее время основным методом подтверждения гидронефроза. Важным дополнением является катетеризация мочевого пузыря во время исследования у младенцев и полное опорожнение детрузора до обследования у старших детей.
Рис.5. А. Экскреторная урография выявила у мальчика 4-х лет с повторными болями в животе и подъемами температуры двусторонний гидронефроз.
В. Предоперационная микционная цистография установила двусторонний ПМР 4 ст. с обеих сторон. (SB Bauer,Campbell’s Urology 1997)
На экскреторных урограммах в случае гидронефроза отмечается расширение лоханки и чашечек, мочеточник не контрастируется, либо определяется в дистальных отделах без признаков расширения диаметра. Максимальное увеличение размеров коллекторной системы почки наблюдается на поздних или отсроченных снимках (40 минута, 90 мин., 3часа.). Лазиксная проба на фоне экскреторной урографии используется для уточнения диагноза преимущественно у старших детей (Н.А.Лопаткин, А.Г.Пугачев (1984). Методика данного исследования заключается в следующем: ребенок предварительно обильно поится (гидратация), опорожняет мочевой пузырь. Первый исходный снимок выполняется на 15 мин. после введения контрастного вещества ( в стандартных возрастных дозировках). Далее внутривенно вводится лазикс из расчета (1мг/кг). Выполняются 3 снимка на 1мин.,5мин. и 10 мин. после введения лазикса. Признаками обструкции считают увеличение размеров лоханки и чашечек на 30% по сравнению с исходными размерами (15 мин.).
В редких случаях, несмотря на проведенные лазиксные пробы и инфузионную ренальную сцинтиграфию, диагноз обструкции остается сомнительным. В таких случаях может быть показано исследование константы перфузорного давления. В 1973 году Whitaker описал метод определения константны скорости перфузии почечной лоханки, составляющей в норме 10 мл/мин. Он пришел к заключению, что разница в давления в почечной лоханке и мочевом пузыре менее 13 см Н2О является нормой. Увеличение этого показателя выше 22см Н2О говорит об обструкции. Измерение давления в лоханке в классическом варианте пробы выполняют при пункции коллекторной системы в поясничной области. В связи с плохой воспроизводимостью результатов теста Whitaker некоторые исследователи предложили определять перфузию почечной лоханки при постоянном давлении с измерением прохождения жидкости через мочеточник для выяснения вопроса – имеется ли обструкция или нет Ripley (1982). Эти методы однако, обычно требуют в детском возрасте общего наркоза, а поэтому применение их у детей ограничено D.Ellis (1997).
Оперативное лечение гидронефроза при установленном диагнозе целесообразно провести в течение 1 года жизни ребенка, оптимальный возраст 4-6 мес. (Perlmutter et al., 1980; Roth and Gonzales,1983; King et al., 1984). Возраст 4-6 мес. считается идеальным для проведения комплекса урологических обследований по выявлению характера обструкции мочеточника со стороны функции почек (радиоизотопное обследование у новорожденных нередко малоинформативно или дает недостоверные результаты). Пластика ПУС у новорожденных возможна, но сопряжена в большими анестезиологическими и операционными рисками. К 4-6 мес. ребенок почти удваивает свой вес и значительно увеличивает длину тела, соответственно становятся больше размеры почки и мочеточника. Эти аспекты позволяют более надежно выполнить пластику мочеточника и получить лучшие результаты.
Большинство европейских клиник следуют стандартам F.Ransly (известный детский уролог. Лондон), созданным на основании 20 летнего опыта лечения новорожденных детей с гидронефрозом.
Пренатально диагносцированный гидронефроз:
1. Односторонний гидронефроз:
А. Передне-задний размер лоханки меньше 12мм.
У детей без расширения лоханки нет риска оперативного вмешательства 0%.УЗИ в 1неделю, триметоприм до 6-12 мес, проведений НСГ (нефросцинтиграфии статика) не обязательно, но возможно в 3 мес. Далее УЗИ в 3мес, 1год, 2,5,10лет.
Б. Размер лоханки 13-19 мм: тоже + НСГ в 3мес и 1год, возможно в 2,5 и 10 лет. При улучшении или стабилизация размеров ЧЛС можно не проводить РИИ.
В. Лоханка 20-50 мм: НСГ в 1мес. По его результатам деление на 4 группы:
А) функция ниже 10%- нефрэктомия
Б)- 11-31% — ранняя пиелопластика
В)- 31-39% — повторное РИИ в 3мес
Если наблюдается ухудшение функции почки или функция не изменилась, но нарастает расширение ЧЛС на УЗИ, то пиелопластика, остальные переходят в группу Д.
Г)- »40% УЗИ в 6 мес., 1год, и каждый год далее.
Радиоизотопное исследование проводится повторно только если увеличивается ЧЛС. Операция показана при ухудшении функции меньше 40 %, или появлении симптомов.
Процент оперативных вмешательств :
20-29мм- 30%,
30-39% — 40%,
40-49%- 70%.
Методы операции.
1. При лечении гидронефроза операцией выбора (золотой стандарт) остается пластика прилоханочного отдела мочеточника по Хайнсу-Андерсену (Рис.6).
Рис.6 Операция Хайнса-Андерсена.
А. Определение зоны стеноза мочеточника. Б. Иссечение стеноза, резекция лоханки, рассечение мочеточника вдоль.В. Формирование лоханочномочеточникового анастомоза.
2. Пиелопластика вертикальным лоскутом
Рис.7 Этапы пластики лоханочномочеточникового сегмента вертикальным лоскутом лоханки.
3.Пиелопластика Y-V образная (Foley)
Рис.8 Схема пластики мочеточника по Фолею
4. Уретерокаликоанастомоз. Вариант соединения мочеточника с нижней чашечкой (при внутрипочечной лоханке
Рис.9 Схема операции уретерокаликоанастомоз
Лечение гидронефроза у детей до недавнего времени сопровождалось высоким процентом послеоперационных осложнений, достигающим 20-36% [1,2,3]. На сегодня в лечении гидронефроза существуют определенные достижения. Широкое использование УЗИ улучшило диагностику гидронефроза, в том числе и в пренатальном периоде. Усовершенствование методик операций, прецизионный шов, оптимальный выбор шовных материалов, рациональная антибактериальная терапия позволили снизить процент осложнений до 4-8%.[2,5,7,8]
В последнее десятилетие широко используют малоинвазивные (щадящие) способы лечения гидронефроза .
Последние 6 лет мы выполняем операции по поводу гидронефроза из лапароскопического доступа.Успешно оперированы более 85 больных
В нашем распоряжении самая современная эндоскопическая аппаратура , работаем миниатюрными (3 и 5мм) детскими инструментами, через точечные разрезы(Рис.11). Травматичность операций минимальна для пациента. Используются внутренние методы дренирования почки (стенты)(Рис.12) , позволяющие отказаться от наружного выведения дренажных трубок на коже больного. Результаты лечения хорошие. По вопросу лечения лапароскопически гидронефроза пишите по адресу (присылайте заключения УЗИ и снимки урограмм)
Рис. 11. Ребенок 2 лет после лапароскопической пластики ЛМС по поводу гидронефроза.Имеется толька трубка – страховочный дренож из брюшной полости на 3-5 дней.
Рис. 12. Ребенок 5 лет после лапароскопической операции.
Рис.12. Лапароскопическая операция.
Рис. 13. Установка внутреннего стента в мочеточник
Рис.14. Внешний вид сформированного анастомоза лоханки с мочеточником
Рис.15. Рентгенограмма ребенка с гидронефрозом справа (абберантный сосуд). Тот же больной через 1 год после операции.
Доктор Рудин Ю.Э. ;
ЛИТЕРАТУРА:
- Рудин Ю.Э., Марухненко Д.В., Лагутин Г.В. Варианты дренирования верхних мочевых путей после лапароскопической пиелопластики у детей . Экспериментальная и клиническая урология. — 2020. — №2. — С.118-125
- Рудин Ю.Э., Арустамов Л.Д.,Марухненко Д.В,Лагутин Г.В. Роль эндопиелотомии в детской практике при коррекции сужений лоханочно- мочеточникового сегмента. Экспериментальная и клиническая урология. 2015. №3, С.92-95 .
- Рудин Ю.Э., Марухненко Д.В., Арустамов Л.Д., Лагутин Г.В. Эндовидеохирургия при лечении обструкции пиелоуретерального сегмента у детей. Экспериментальная и клиническая урология. 2014г. №4 С98-103
- Рудин Ю.Э., Осипова А.И., Кузнецова Е.В. Оптимальные методы дренирования мочевыводящих путей после пластики прилоханочного отдела мочеточника у детей с гидронефрозом. Детская хирургия. 2000. №5. С. 16 – 19
- Врублевский С.Г. Оптимизация хирургического лечения гидронефрозов у детей.// дис. М 1993.
- G. Framo, C. De Dominicis, S. Dal Forno.The Icidence of Post- oper. Urin Tract Inf. In Patients with Ur. Stent.// Br. J. Urol. 1990 Jun.65(1).
- Мудрая И.С. Эффект уретрального стента.
- Anderson JC, Hynes W. Retrocaval ureter: a case diagnosed preoperatively and treated successfully by a plastic opera¬tion. // Br J Urol 1949. Vol. 21. P. 209-14.
- Lim DJ, Walker RD 3rd.//Management of the failed pyeloplasty.// J. Urol. 1996 Aug. 156 ( 2 Pt 2), 738- 40.
- Thomas DF, Agravwal M, Laidin AZ, Eckstein HB.// Pelviureteric obstruction in infancy and childhood.//Br. J. Urol. 1982 Jun.54 (3 ): 204-8.
- Ahmed S, Crankson S.// Non- intubated pyeloplasty for pelviureteric junction obstruction in children.// Pediatr. Surg. Int. 1997 Jul. 18, 12 ( 5/6 ), 389-92.
Противопоказания
К основным противопоказаниям для проведения любого оперативного вмешательства относятся следующие факторы:
- беременность;
- наличие сахарного диабета;
- тяжелые заболевания сердечно-сосудистой системы;
- нарушение в работе коагуляционной системы крови;
- инфекционные заболевания.
У пациента также могут быть выявлены индивидуальные противопоказания, поэтому важно пройти полное обследование и должным образом подготовиться к проведению операции.
Когда показана лапароскопическая пластика ЛМС?
Пластика проводится при обструкции (от лат. obstructio
— препятствие) лоханочно-мочеточникового сегмента. Обструкция лоханочно-мочеточникового сегмента характеризуется функционально значимым нарушением оттока мочи, причиной которой могут служить либо внутреннее, либо наружное сдавление области, где лоханка почки переходит в мочеточник.
Внешние причины гидронефроза
(т.е. исходящие не из мочеточника)
Наиболее частая причина — аномальные сосуды кровоснабжающие нижний полюс почки (аномалия проявляется как в количестве, так и в локализации добавочных сосудов) плотно прилегающие к области лоханочно-мочеточникового сегмента. Постоянное соприкосновение сосуда с мочеточником вследствие их пульсации приводит к образованию рубцовой ткани в лоханочно-мочеточниковом сегменте, которая, сужая его просвет, приводит к обструкции и гидронефрозу.
Внутренние причины гидронефроза
- врожденные (врожденное сужение или спайки ЛМС);
- приобретенные стриктуры ЛМС (травматические, после манипуляций на мочеточнике (уретероскопия, стентирование мочеточника), постлучевые (после лучевого лечение в области ЛМС), туберкулезное поражение, и т.д.)
- опухоли мочеточника (в большинстве случаев доброкачественные, при злокачественных опухолях мочеточника объем операции в разы превышает объемы лечения доброкачественных опухолей).
Подготовка к оперативному вмешательству
Перед проведением пластики мочеточника врач должен провести тщательное обследование и оценку состояния здоровья пациента. Важно своевременное выявление инфекций мочеполовой системы.
При их обнаружении проводится курс антибактериальной терапии, и лишь после этого выполнение оперативного вмешательства. Также пациент обязан сдать анализы для оценки показателей свертываемости крови и т. д.
Проведение аллергопроб важно для выявления возможных аллергических реакций на препараты и материалы, используемые в ходе оперативного вмешательства. Еще одним важным этапом является бактериологическое исследование.
После тщательного сбора анамнеза жизни, заболевания, оценки полученных данных анализов врач сможет назначить дату операции.
Уретеролиз
Как делают пластику мочеточника – вопрос, который часто задают пациенты. Уретеролиз выполняют лапароскопическим методом. Инструменты вводят в брюшинное пространство через несколько небольших разрезов. В ходе операции хирург освобождает мочеточник от фиброзной ткани, поскольку она сдавливает канал и мешает его нормальной работе, в тяжелых случаях приводит к непроходимости.
Удаление рубцовой ткани способствует притоку крови к мочеточнику, что улучшает его питание, способствует нормальному функционированию. Для предупреждения рецидивов хирург наращивает вокруг канала лоскут жировой ткани. После такой манипуляции образование новой фиброзной ткани проходит вокруг жирового слоя, что препятствует сдавливанию мочеточника.
Виды операций на мочеточнике
Хирургическое вмешательство может проводиться под эндотрахеальным общим наркозом.
После введения определенной дозы анестезирующего препарата пациенту устанавливается катетер, который способствует выведению мочи во время операции и периода реабилитации. Операции осуществляется посредством:
- Кишечной пластики лоханочно-мочеточникового сегмента: сегментарная замена мочеточника с помощью трансплантата из мочевого пузыря или кишечника.
- Уретероуретероанастомоза: происходит удаление поврежденного сегмента и дальнейшее сшивание мочевыводящих путей.
- Кишечная пластика
Полная или же частичная замена мочеточника подразумевает замену органа с помощью трансплантата, сформированного из тканей кишечника.
Лоскут кишки образует стенки мочеточника, внутри находится временный катетер, после этого он сшивается с почечной чашкой для создания нового мочеточника.
При наличии функционирующего участка органа выполняется сегментарная пластика: сшивание трансплантата со здоровым участком и вывод катетера наружу.
Он будет выполнять функцию мочеточника до полного восстановления сегмента. Частичная пластика может применяться при необходимости удаления опухоли или большого участка пораженного органа.
- Операция по Боари
Для проведения этого вида хирургического лечения характерно формирование будущей трубки мочеточника из стенки мочевого пузыря.
Из его тканей иссекается небольшой участок, размер которого будет больше пораженной области (для предотвращения сжатия мочеточника). Такая операция используется при парном поражении мочеточников.
- Эндопластика устья мочеточника
Этот вид пластики может применяться при выявлении у пациента пузырно-мочеточникового рефлюкса. При проведении этой операции риск развития послеоперационных патологий и осложнений минимален.
Пластика проводится с использованием объемообразующего геля, который вводится посредством иглы под слизистую. Благодаря этому происходит расширение мочеточника. Затем в его полость вводится катетер на последующие 12 часов послеоперационного периода.
- Уретероуретероанастомоз
Этот вид оперативного вмешательства применяется при диагностировании злокачественных новообразований, затрагивающих мочеточник, пузырно-мочеточникового рефлюкса и пиелонефрита.
Его суть состоит в соединении участков мочевыводящего канальца с помощью анастомоза: две части мочеточника соединяются в одну протоку. Все пораженные участки замещаются имплантатами.
Лечение
Единственным методом, позволяющим вылечить болезнь полностью, остается хирургическая операция. Проводятся такие вмешательства:
Радикальная нефроуретерэктомия. Проводится у большинства пациентов. Предполагает удаление мочеточника и почки на стороне поражения. Выполняется также диссекция лимфатических узлов. Операция может быть проведена лапароскопическим доступом. Но при большом размере опухоли требуется открытая операция. В последние годы дополнительно выполняют резекцию (частичное удаление) мочевого пузыря, так как это резко снижает частоту рецидивов.
Сегментарная резекция мочеточника. Обычно выполняется малоинвазивным способом. Эта операция предполагает удаление фрагмента мочеточника, пораженного опухолью. Она возможна только при небольших опухолях, которые располагаются неподалеку от мочевого пузыря.
Трансуретральная или чрескожная эндоскопическая резекция мочеточника. Имеет ограниченное применение, так как после этой операции часто встречаются рецидивы опухоли и стриктуры (локальные сужения) мочеточника. Такие эндоскопические вмешательства выполняются только в случае наличия противопоказаний к радикальной нефроуретерэктомии. Например, если у пациента осталась только одна почка, либо функция почки на стороне отсутствия опухоли резко снижена.
Химиотерапия может быть назначена после операции, изредка — до операции, для уменьшения размеров опухоли. Она становится основным методом лечения при неоперабельных опухолях. Реже применяется иммунотерапия. Обычно её используют при неоперабельном раке. Лучевая терапия применяется редко, в основном как паллиативный метод.
Реабилитационный период
После завершения операции все пациенты переводятся в отделение реанимации и интенсивной терапии до полной стабилизации их состояния. В первые несколько дней больной должен находиться под постоянным контролем специалистов.
Контроль состояния пациента и его витальных функций в стационаре осуществляется посредством специальных датчиков и сбора данных о количестве выделяемой мочи. Спустя несколько дней удаляются катетеры.
Длительность нахождения больного в стационаре зависит от его состояния, сложности проведенного вмешательства, состояния прооперированных органов.
При использовании лапароскопического доступа пациент находится в клинике не более 3-4 дней, а при выполнении полостной операции этот срок может увеличиваться до 2-3 недель.
Важно! После пластики необходимо четко придерживаться всех рекомендаций врача.
На протяжении следующих 2-3 месяцев после проведения операции врачи советуют ограничить некоторые виды физических нагрузок: пациенту запрещается поднимать тяжести и заниматься тяжелым физическим трудом.
Также обязательным условием является систематическое посещение специалиста для планового осмотра. Это необходимо для динамического наблюдения за состоянием трансплантата и работой мочевыделительной системы.
По результатам полученных данных врач может корректировать план медикаментозной терапии или режим.
Обращение к немецкой медицине
Анна: «Мы отправили запрос сразу в несколько компаний, которые специализируются на организации лечения за границей, выбирали между Германией и Израилем. Времени было мало. Среди всех компаний, в которые мы обратились, самой компетентной оказалась GLORISMED. Её сотрудники оперативно передали нашу историю болезни главному врачу профильной клиники урологии, расположенной в Берлине».
Профессор, которому был отправлен запрос на лечение Ларисы, является членом союза Германии по лечению опухолевых заболеваний почек. Он разрабатывает стандарты операций на почках и прилежащих органах, которые затем применяются в профильных клиниках Германии. На следующий же день после получения запроса он ответил, что операция возможна и с большой долей вероятности даже может быть проведена малоинвазивно.
Возможные осложнения
Осложнения при проведении лапароскопической пластики мочеточника могут возникать как во время хирургического вмешательства, так и после его завершения. Их можно разделить на несколько групп:
- последствия, связанные с анестезией: нарушения кровообращения, остановка дыхания при извлечении трубки для интубации, попадание содержимого желудка в дыхательные пути, пневмония и т. д.;
- осложнения, связанные с особенностями лапароскопического доступа: возможность повреждения тканей внутренних органов во время установки троакаров, нарушение кровообращения из-за нагнетания углекислого газа во внутренние полости организма пациента и т. д.;
- осложнения, связанные с самой операцией: кровотечения во время проведение хирургического вмешательства или после, инфекция послеоперационной раны или мочевыделительной системы, в редких случаях возможно повреждение почки.
В раннем послеоперационном периоде может наблюдаться несостоятельность швов, приводящая к утечке мочи и необходимости проведения повторного оперативного вмешательства.
На поздних этапах возможен рецидив гидронефроза из-за сужения пересаженного сегмента в месте проведения пластики.
Также у некоторых пациентов может возникнуть необходимость проведения операции с открытым доступом во время проведения лапароскопии из-за технических сложностей во время выполнения пластики мочеточника.
При полостной операции осложнением также может стать развитие грыжи.
Послеоперационный уход
Реабилитация после операции при гидронефрозе длится около месяца. За это время заживают рассеченные ткани, восстанавливается нормальная работоспособность органа.
Пациенты после выписки из стационара в течение 1-2 месяцев наблюдаются у уролога. Также им рекомендуют все это время принимать уроантисептические препараты. В течение месяца после операции существует необходимость в исключении физических нагрузок и соблюдении диеты. Больному запрещено употреблять соленые, острые, жареные блюда и алкогольные напитки.
Восстановление
После пластики мочеточника нужно ограничить нагрузки, соблюдать диету и обрабатывать рану.
После выписки пациенту следует придерживаться определенных рекомендаций, что способствует скорому заживлению тканей и предупреждает риск возникновения осложнений на этапе реабилитации без постоянного наблюдения врача. Соблюдение диеты направлено на снижение уровня кислотности мочи, что уменьшает вероятность раздражения тканей.
Сильные нагрузки, активные занятия спортом исключаются в этот период ввиду риска расхождения швов. Если же пациент ощущает усиление болей или наблюдает качественные изменения мочи, то следует незамедлительно сообщить об этом, для изменения характера последующего лечения. Уход за раной осуществляется по рекомендациям врача, потому необходимо своевременно делать перевязку раны. Скорость удаления швов определяется в процессе реабилитации.
Как проводится лапароскопическая пластика гидронефроза?
Операция проводится под общим наркозом (происходит погружение в сон на время всей операции). Доступ к почке и мочеточнику осуществляется при помощи 3 маленьких отверстий около 0,5-1 см. на передней брюшной стенке. Пациента укладывают в положение на боку, противоположном стороне поражения. Создается пневмоперитонеум (брюшная полость заполняется углекислым газом) с помощью иглы Вереша через небольшое отверстие в околопупочной области.
Первой в брюшную полость вводится лапароскоп (камера), а затем уже инструменты под контролем лапароскопа, для того чтобы не травмировать соседние органы. Всего будет введено 3-4 инструмента, включая лапароскоп.
Далее начинается процесс выделения почки, ее лоханки и мочеточника. После этого производится пластика одним из известных методов (по Андерсену-Хайнсу, Кальпа-де Вирда, Фенгера и т.д.). При выполнении пластики по Андерсену-Хайнсу (наиболее распространенная операция) отсекают часть мочеточника и лоханки, ниже и выше обструкции, соответственно, далее накладывается анастомоз между ними (т.е. они сшиваются). Непосредственно перед накладыванием анастомоза в мочеточник вводят катетер-стент, который удаляется через 3 недели после операции. Операцию заканчивают дренированием зоны анастомоза, удаляются инструменты и зашивается кожа.
см. соответствующий клинический пример на нашем сайте: лапароскопическая пластика гидронефроза.