Главная » Эндокринные заболевания » Гиперкортицизм
Гиперкортицизм — эндокринное заболевание, характеризующееся достаточно долгим воздействием на организм человека сверхнормативного количества кортизола — гормона синтезируемого надпочечниковой корой, либо злоупотреблением глюкокортиокидами. Другое название гиперкортицизма — синдром Иценко Кушинга. Женщины в 10 раз чаще мужчин страдают гиперкортицизмом, и, в основном, в возрасте от 25 до 40 лет. Гиперкотицизм проявляется тем, что кортизол в больших количествах замедляет выработку глюкозы, которая очень необходима нашим клеткам. В результате этого, функциональность многих клеток падает и наблюдается атрофирование тканей.
Гиперкортицизм: что это такое?
Гиперкортицизм или синдром Иценко-Кушинга, представляет собой эндокринную патологию, связанную с продолжительным и хроническим воздействием на организм избыточного количества кортизола. Такое воздействие может возникать вследствие имеющихся недугов или на фоне приема некоторых медикаментов. Женщины в 10 раз чаще мужчин страдают гиперкортицизмом, и, в основном, в возрасте от 25 до 40 лет.
Чтобы нормально функционировал гипофиз, необходима достаточная выработка конкретных гормонов гипоталамусом. Если нарушается эта цепочка, то страдает весь организм и это сказывается на состоянии здоровья человека. Впервые клиническая картина эндогенного гиперкортицизма была описана в 1912 г. Гарвеем Кушингом.
Гиперкотицизм проявляется тем, что кортизол в больших количествах замедляет выработку глюкозы, которая очень необходима нашим клеткам. В результате этого, функциональность многих клеток падает и наблюдается атрофирование тканей.
- Код по МКБ 10: E24.0
Патогенез
Основу болезни составляет нарушение обратной связи в функциональной системе гипоталамус-гипофиз – кора надпочечников, характеризующееся постоянно высокой активностью гипофиза и гиперплазией кортикотропов или, значительно чаще, развитием АКТГ- продуцирующих аденом гипофиза и гиперплазией коры обоих надпочечников.
В результате этого повышается скорость продукции и суммарная суточная экскреция практически всех фракций кортикостероидов с развитием симптомов гиперкортицизма. В основе синдрома Иценко-Кушинга лежит формирование автономной доброкачественной или злокачественной опухоли надпочечника или дисплазии надпочечника.
Синдром гиперкортицизма приводит к снижению либидо как у женщин, так и у мужчин. У последних он проявляется еще и импотенцией.
Механизм развития болезни
В основе развития гиперкортицизма лежит повышенная секреция кортизола. Данный гормон провоцирует распад белков костей, мышц, кожи и внутренних органов. Со временем это приводит к дистрофии и атрофии тканей. Усиленная выработка глюкозы приводит к развитию стероидной формы диабета. Нарушение жирового обмена сопровождается характерным отложением жира в определенных зонах. Избыточная концентрация кортизола влияет и на почки. Как результат — в плазме крови повышается уровень натрия и снижается концентрация калия. Такие пациенты страдают от повышенного артериального давления, а в мышечной ткани усиливаются дистрофические процессы.
Сильнее всего при гиперкортицизме страдает миокард. Внешне это проявляется нарушением сердечного ритма, сердечной недостаточностью, кардиомиопатией.
Причины
На сегодняшний день медикам не удалось до конца изучить причины, которые влияют на нарушение функции надпочечников. Известно лишь, что при любом факторе, который провоцирует повышение выработки гормонов надпочечниками, развивается заболевание. Провоцирующими факторами гиперкортицизма считаются:
- аденома, возникшая в гипофизе;
- образование опухолей в легких, поджелудочной, бронхиальном дереве, которые продуцируют АКТГ;
- длительный прием глюкокортикоидных гормонов;
- наследственный фактор.
Помимо вышеперечисленных факторов, на возникновение синдрома могут повлиять такие обстоятельства:
- травмирование или сотрясение мозга;
- черепно-мозговые травмы;
- воспаление паутинной оболочки спинного или головного мозга;
- воспалительный процесс в головном мозге;
- менингит;
- кровотечение в субарахноидальное пространство;
- повреждения центральной нервной системы.
Иногда признаки синдрома могут быть вызваны совсем другими факторами, но это только временное явление и не означает, что у человека истинный гиперкортицизм.
Частые причины развития псевдо – синдрома Кушинга – это ожирение, хроническая алкогольная интоксикация, беременность, стресс и депрессия, а иногда даже прием оральных контрацептивов, которые содержат смесь эстрогенов и прогестерона.
Повышение уровня кортизола в крови может произойти даже у грудных детей, когда в их организм вместе с грудным молоком поступает алкоголь.
Купить онлайн
Синдром Кушинга (СК; эндогенный гиперкортицизм — ЭГ) — комплекс клинических симптомов, обусловленных длительным воздействием кортикостероидов на организм вследствие их избыточной эндогенной продукции. ЭГ представлен двумя формами: АКТГ-зависимым (80%) и АКТГ-независимым (15—20%). Наиболее частой причиной АКТГ-зависимого гиперкортицизма является кортикотропинома гипофиза (болезнь Кушинга — БК, гиперкортицизм центрального генеза), реже — эктопическая продукция АКТГ опухолью или, крайне редко, эктопическая продукция кортикотропин-рилизинг-гормона (КРГ). В большинстве случаев причиной заболевания АКТГ-независимым гиперкортицизмом служит опухоль коры надпочечника (кортикостерома или реже адренокортикальный рак). АКТГ-независимая гиперплазия надпочечников (как мелко-, так и крупноузелковая) представляет собой узелковую гиперплазию пучковой зоны коркового вещества надпочечников. Эта гиперплазия является результатом избыточного либо неадекватного действия различных факторов, например необычной экспрессии рецепторов в корковом веществе надпочечников к различным гормонам (желудочному ингибиторному пептиду, лютеинизирующему гормону, хорионическому гонадотропину и т.д.). [1]. Наследственные формы гиперплазии надпочечников включают мелкоузелковую гиперплазию коркового вещества надпочечников (одно- либо двустороннюю) в рамках симптомокомплекса Карни и синдрома Маккьюна—Олбрайта [2] (табл. 1).
На практике наиболее частой причиной развития клинических признаков гиперкортицизма является экзогенный прием глюкокортикоидов, в связи с чем перед проведением диагностических исследований крайне важно исключить возможные варианты попадания в организм кортикостероидных препаратов.
Отдельно следует упомянуть псевдокушингоидные состояния, сопровождающиеся гиперкортизолемией без развития ярких клинических признаков гиперкортицизма, наличие которых важно учитывать при обследовании.
Клиническая картина
При развернутой клинической картине гиперкортицизма, как правило, топическое и гормональное исследования проводят целенаправленно для диагностики клинического варианта заболевания (поражения надпочечников, гипофиза, АКТГ-эктопический синдром и др.).
К основным клиническим признакам гиперкортицизма относят:
— диспластическое ожирение (перераспределение подкожно-жировой клетчатки с отложением жира в надключичных областях, шейном отделе позвоночника при сравнительно тонких конечностях, «лунообразное лицо»);
— трофические изменения кожных покровов, появление багровых стрий шириной более 1 см;
— артериальная гипертензия (АГ);
— вторичный гипогонадизм (ранний симптом, может проявляться нарушением менструального цикла, снижением либидо);
— нарушения углеводного обмена (стероидный сахарный диабет — СД);
— проксимальная миопатия (мышечная слабость, атрофия мышц);
— оппортунистические и грибковые инфекции вследствие вторичного иммунодефицита;
— остеопороз позвоночника (при наличии остеопении в молодом возрасте необходимо исключение наследственных форм гиперплазии надпочечников) [2];
— нефролитиаз и воспалительные изменения в почках;
— энцефалопатия, психические расстройства;
— гирсутизм — чаще встречается при АКТГ-зависимых формах СК, а также при адренокортикальном раке [3];
— сочетание типичных признаков гиперкортицизма с резко выраженной мышечной слабостью, гиперпигментацией кожных покровов, снижением массы тела (симптомокомплекс является клинической особенностью АКТГ-эктопического синдрома) [4—6].
Из перечисленных признаков наиболее специфичными («большие признаки») являются наличие фиолетово-багровых стрий шириной более 1 см, подкожных кровоизлияний, проксимальная миопатия, гиперемия лица, одновременное нарушение роста и увеличение массы тела у детей. Однако при ЭГ, чаще всего при кортикостероме, стрии могут отсутствовать [2, 7].
Наиболее характерным лабораторным признаком гиперкортицизма служит гипокалиемия (при эктопической секреции АКТГ уровень калия практически всегда понижен, что может быть очень полезным в дифференциальной диагностике; однако у 10% пациентов с болезнью Кушинга также выявляется гипокалиемия), иногда гипернатриемия.
Диагностика синдрома Кушинга
На первом этапе обследования необходимо подтверждение или исключение ЭГ. Согласно рекомендациям Европейского общества эндокринологов (2008), такое обследование показано в следующих случаях [7]:
1. Наличие несоответствующих возрасту патологических состояний: остеопороз, артериальная гипертензия (АГ) у молодых.
2. Наличие нескольких прогрессирующих патологических симптомов, патогномоничных для гиперкортицизма.
3. Сочетание нарушения роста и увеличения массы тела у детей.
4. Наличие инциденталомы.
Для определения повышенной продукции кортизола в организме используют следующие лабораторные методы исследования и диагностические тесты [4—9]:
1. Ночной подавляющий тест с 1 мг дексаметазона (ПТД1).
В основе пробы лежит подавление секреции АКТГ и, как следствие, снижение продукции кортизола в ответ на прием дексаметазона [7]. По данным исследований, проведенных P. Wood, J. Barth, D. Freedman, L. Perry, B. Sheridan, чувствительность и специфичность теста составляют 95 и 80% соответственно при снижении содержания кортизола в крови менее 50 нмоль/л [10]. Предварительная подготовка не требуется. Возможно амбулаторное проведение теста при уверенности в том, что пациент примет таблетки вовремя.
Методика проведения:
пациент принимает 1 мг дексаметазона в 23.00, в 8—9 ч следующего утра берут кровь для исследования уровня кортизола. При проведении теста не требуется определение исходной утренней точки кортизола для сравнения. В норме уровень кортизола подавляется менее нижней границы нормы для данной лаборатории, обычно менее 5 мкг/дл (<3 мкг/дл по рекомендациям других авторов) или 140 (100) нмоль/л. Однако ряд исследователей предлагают использовать более жесткие критерии: снижение кортизола должно быть менее 1,8 мкг/дл (50 нмоль/л). Существует ряд лекарственных препаратов, влияющих на уровень кортизола крови. Так, эстрогены, входящие в состав комбинированных пероральных контрацептивов (КОК), повышают уровень кортизолсвязывающего глобулина крови. Поскольку в крови измеряется содержание общего кортизола, у 50% женщин, принимающих КОК, ПТД1 может быть ложноположительным. По возможности рекомендуется их отмена за 6 нед до исследования (табл. 2).
Напротив, снижение концентрации кортизолсвязывающего глобулина или альбумина возможно при тяжелых соматических заболеваниях, а также при хронической почечной недостаточности, что приводит к снижению уровня общего кортизола в сыворотке крови.
Причины ложноположительных результатов:
1. Псевдокушингоидные состояния.
2. Прием лекарственных препаратов (см. табл. 2).
3. Нарушение порядка проведения пробы.
4. Перекрестная реактивность.
2. 48-Часовой подавляющий тест с 2 мг в день дексаметазона (ПТД2).
Некоторые авторы предпочитают использовать данный тест в качестве скринингового, особенно при подозрении на псевдокушингоидное состояние, а также для исключения субклинического синдрома Кушинга (ССК).
Методика проведения:
дексаметазон назначается по 0,5 мг каждые 6 ч в течение 48 ч, кортизол определяют в 9 ч утра на 3-й день (через 6 ч после приема последней таблетки дексаметазона). В норме уровень кортизола составляет менее 1,8 мкг/дл (50 нмоль/л).
3. Исследование уровня свободного кортизола в слюне в вечернее время, двукратное определение
(чувствительность 92—100%, специфичность 93—100%) [11]. В норме уровни кортизола в слюне в 23—24 ч не превышают 145 нг/дл (4 нмоль/л) при использовании твердофазного иммуноферментного анализа (ELISA) или масс-спектрометрии. Пока до конца не изучено влияние возраста пациентов и сопутствующих заболеваний на содержание кортизола в слюне. Однако, по данным Н.Liu и соавт. [12], при исследовании уровня кортизола слюны в 23.00 у мужчин старше 60 лет, у 20% всех обследуемых и у 40% страдающих СД в сочетании с АГ, имелся как минимум один повышенный показатель. У пациентов, принимающих препараты лакрицы, использующих жевательный табак или курящих, а также на фоне стресса может определяться повышенный уровень кортизола в слюне. Использование кремов или гелей для полости рта с глюкокортикостероидами (ГКС) также может изменять результаты анализа.
4. Определение содержания свободного кортизола в суточной моче (двукратное определение).
Пациентам должны быть объяснены правила сбора суточной мочи: первая порция мочи после сна не собирается, а собираются все последующие, включая утреннюю порцию второго дня. Посуду для сбора мочи необходимо держать в холодильнике, но не замораживать. К ложноположительным результатам могут приводить избыточный прием жидкости (более 5 л в сутки), использование содержащих ГКС препаратов, косметических средств, псевдокушингоидные состояния (при данных состояниях уровень свободного кортизола в суточной моче редко превышает референсные значения более чем в 4 раза). К ложному снижению содержания уровня кортизола в моче может приводить снижение клиренса креатинина менее 60 мл/мин.
Тест имеет высокую чувствительность (95%), но низкую специфичность.
У 9% пациентов с ЭГ как минимум один результат исследования уровня свободного кортизола в суточной моче находится в пределах нормы.
К недостаткам метода относятся следующие:
— повышенный уровень свободного кортизола в суточной моче был обнаружен у многих пациенток с синдромом поликистозных яичников;
— большинство проблем связано с правильностью сбора мочи пациентами;
— при экзогенном приеме ГКС уровни свободного кортизола в моче будут повышены (перекрестная реакция): преднизолон и метилпреднизолон, в отличие от дексаметазона, обладают перекрестной реактивностью с кортизолом. Низкий уровень дигидроэпиандростерона-сульфата (ДГЭА-С) из-за подавления АКТГ может быть обнаружен и является полезным дополнительным признаком экзогенного применения ГКС.
5. В качестве дополнительного теста
может служить исследование уровня кортизола крови в 23.00 ч, в частности у пациентов, принимающих противосудорожные препараты, а также в случае сомнительных результатов при ПТД1, и исследовании содержания кортизола суточной мочи. Измерение кортизола сыворотки в ночное время (23.00) можно проводить во время сна (кровь должна быть взята не позднее чем через 5—10 мин после просыпания, предварительная катетеризация облегчает данную процедуру) либо в состоянии бодрствования. Уровень кортизола в сыворотке крови более 207 нмоль/л (7,5 мкг/дл) во время бодрствования либо более 50 нмоль/л (1,8 мкг/дл) в пробе, взятой во время сна, характерен для СК.
6. Комбинированный тест: ПТД2 + стимуляция КРГ.
Может быть использован при сомнительных результатах определения свободного кортизола в суточной моче, а также результатов, полученных в ходе ПТД1 и ПТД2. У некоторых пациентов с ЭГ прием дексаметазона может привести к адекватному снижению уровня кортизола в ходе ПТД2. Однако если после приема дексаметазона ввести КРГ, у лиц с ЭГ будет определяться повышение уровня АКТГ и, соответственно, кортизола в крови (в отличие от случаев функционального гиперкортицизма и в отсутствие ЭГ).
Методика проведения:
дексаметазон принимают по 0,5 мг каждые 6 ч в течение 48 ч (начало приема с 12.00 дня), КРГ в дозе 1 мкг/кг (максимально 100 мкг) вводят внутривенно в 8.00 (через 2 ч после приема последней дозы дексаметазона). Уровень кортизола в крови определяют через 15 мин. Его повышение более 1,4 мг/дл (38 нмоль/л) подтверждает диагноз ЭГ. В настоящее время препараты КРГ в РФ не зарегистрированы.
В табл. 3
представлен набор подтверждающих тестов при диагностике ЭГ в особых клинических случаях.
На втором этапе обследования пациентов с подтвержденной гиперсекрецией кортизола в организме проводят дифференциальную диагностику форм ЭГ (кортикостерома, БК, АКТГ-эктопированный синдром и др.). Дифференциальная диагностика форм ЭГ представляет наибольшие затруднения в клинической практике. Для ее осуществления рекомендуется проводить большую пробу с дексаметазоном («большая дексаметазоновая проба» — БДП), а также стимуляционную пробу с кортиколиберином. Данные функциональные пробы основаны на том, что при БК аденома гипофиза продолжает хотя бы частично подчиняться регуляторным механизмам, свойственным здоровой ткани гипофиза (снижение выработки АКТГ в ответ на большие дозы глюкокортикоидов или стимуляция АКТГ в ответ на введение КРГ), в то время как АКТГ-эктопическая опухоль, так же как и опухоли надпочечников, продуцирующие глюкокортикоиды, не обладают такими свойствами. Точность данных тестов ограничена тем, что иногда секреция АКТГ аденомой гипофиза, особенно макроаденомой, не подавляется большими дозами дексаметазона, а некоторые аденомы приобретают полную автономию и не отвечают на стимуляцию КРГ. Кроме того, примерно в 10—30% случаев АКТГ-эктопические опухоли остаются чувствительными к подавляющему влиянию глюкокортикоидов и стимулируются КРГ [13] (см. схему).
Схема 1. Схема алгоритма дифференциальной диагностики при подтверждении наличия эндогенного гиперкортицизма [13]. БДП — большая дексаметазоновая проба; АКТГ — адренокортикотропный гормон; КРГ — кортикотропин-рилизинг-гормон; СК — синдром Кушинга; КТ — компьютерная томография; МРТ — магнитно-резонансная томография; БК — болезнь Кушинга.
А. Дифференциальная диагностика АКТГ-независимых и АКТГ-зависимых форм гиперкортицизма
1. Оценка уровня АКТГ (8.00, 23.00): уровни АКТГ при надпочечниковой форме СК снижены (<10 пг/мл), при БК — повышены (>20 пг/мл), при АКТГ-эктопическом синдроме значительно повышены (более чем в 2,5—3 раза, АКТГ может достигать 100—200 пг/мл и более). Следует помнить, что почти у 10% пациентов с БК уровень АКТГ менее 10 пг/мл [14, 15]. В итальянском исследовании C. Invitti и соавт., включавшем 50 пациентов с надпочечниковой формой СК, почти у 25% уровень АКТГ был в пределах нормы [14], однако остается неясным, было ли это следствием технической ошибки или действительно у пациентов не произошло подавления секреции АКТГ по механизму отрицательной обратной связи. В других работах также приводятся данные об отсутствии снижения уровня АКТГ при надпочечниковой форме гиперкортицизма [16—18]. Интересно описание случая карциномы надпочечника со стабильно высоким уровнем АКТГ вследствие секреции этого гормона опухолью [19]. Уровень АКТГ в плазме крови при БК чаще ниже, чем при эктопическом АКТГ синдроме, но у 1/3 пациентов данная закономерность отсутствует, что не позволяет проводить точную дифференциальную диагностику.
При получении неоднозначных результатов (АКТГ 10—20 пг/мл) рекомендуется провести повторное исследование концентрации АКТГ либо выполнить стимуляционный тест с КРГ.
2. БДП. Возможно проведение как классической большой пробы Лиддла (прием 2 мг дексаметазона каждые 6 ч в течение 2 сут) с исследованием исходной и после приема дексаметазона концентрации свободного кортизола в суточной моче, так и ночной БДП (кортизол крови исходно определяют в 8.00, затем — прием 8 мг дексаметазона в 23.00, повторное определение кортизола крови в 8.00 утра следующего дня). По данным двух многоцентровых исследований [20, 14], чувствительность и специфичность того или иного варианта пробы оказались сопоставимыми и составили соответственно 81—86% и 67—69%, при использовании стандартного критерия — подавление концентрации свободного кортизола в суточной моче либо кортизола крови более чем на 50%. Полученные данные подтверждаются и результатами исследований, выполненных в отдельных центрах [13, 14, 20].
Несмотря на невысокую чувствительность и специфичность данной пробы, ее использование широко распространено в связи с экономической доступностью дексаметазона и относительной надежностью. При проведении этой пробы не стоит забывать, что прием глюкокортикоидов в больших дозах при наличии у пациента эндогенной избыточной продукции кортизола может приводить к временному ухудшению состояния, подъему уровня глюкозы в крови, утяжелению психических расстройств.
3. Тест с КРГ.
Протокол проведения пробы:
необходимо соблюдать следующие условия: последний прием пищи не позднее 20 ч, пациенту заранее устанавливают внутривенный катетер. До проведения теста и во время его пациент находится в горизонтальном положении. Внутривенно вводят 1 мкг/кг (максимально 100 мкг) овечьего КРГ. Уровень АКТГ плазмы и кортизола определяют за 15 мин до введения КРГ (–15), непосредственно перед введением КРГ (0), а затем через 15, 30, 45, 60, 90 и 120 мин.
Тест хорошо переносится, наиболее частым побочным эффектом (20% случаев) является кратковременная гиперемия лица и, редко, затруднение дыхания и гипотензия.
КРГ и его овечий аналог обладают сходными свойствами, однако последний вызывает несколько меньшее увеличение уровня АКТГ и кортизола в плазме у пациентов с БК. Это обусловлено его бóльшим сродством к КРГ-связывающему белку, что приводит к более быстрому выведению из организма.
Интерпретация результатов:
— повышение пикового уровня кортизола по отношению к базальному более чем на 20% свидетельствует о БК. Данный критерий имеет 86% чувствительность и 95% специфичность (по результатам мета-анализа 10 исследований, проведенных Kaye and Crapo [10];
— повышение пикового уровня АКТГ по отношению к базальному более чем на 50% также свидетельствует о БК. Данный критерий имеет 91% чувствительность и 95% специфичность;
— о наличии кортикотропиномы гипофиза свидетельствует также подъем уровня АКТГ на 35% при сравнении среднего значения на 15-й и 30-й минутах теста и базального уровня [21].
Ввиду того, что ни один из фармакологических тестов межнозологической дифференциальной диагностики ЭГ не обладает стопроцентной точностью, рекомендуется комбинированное использование БДП и стимуляционного теста с КРГ. Считается, что совпадение результатов положительной БДП и увеличения уровня АКТГ в ответ на периферическую стимуляцию КРГ с чувствительностью 98—100% и специфичностью 88—100% свидетельствует о БК [22, 23].
Б. Дифференциальная диагностика АКТГ-зависимых форм гиперкортицизма
К сожалению, в настоящее время нет достаточно специфичных фармакологических тестов для дифференциальной диагностики АКТГ-зависимых форм гиперкортицизма.
1. Проба с вазопрессином или десмопрессином.
Это синтетический длительно действующий аналог, отличающийся отсутствием V1-прессорного эффекта. Проба основана на том, что вещества стимулируют выброс АКТГ кортикотропиномой гипофиза путем стимуляции рецепторов V3 (или V1b) кортикотрофов [13].
Чувствительность данного теста у пациентов с БК составляет 82—87%, однако она снижается до 63—67% при других формах СК [12, 24, 25]. Согласно рекомендациям Европейского общества эндокринологов (2008), до получения дополнительных данных исследований, подтверждающих эффективность данного теста, его использование рекомендовано только в научных целях [7].
2. Проба с гексарелином (высвобождающий СТГ пептид-6).
Гексарелин действует через рецептор, стимуляция которого вызывает массивный выброс гормона роста. В то же время данное вещество вызывает в 7 раз более активный выброс АКТГ, чем КРГ, у пациентов с БК. В исследовании M. Korbonits, S. Bustin (2001) было установлено, что экспрессия рецептора гексарелина у 5 из 18 обследованных пациентов с БК и у одного из 3 пациентов с АКТГ-эктопированным синдромом была выше, чем у здоровых людей [26].
3. Проба с метирапоном.
Вещество ингибирует 11β-гидроксилазу, катализирующую превращение 11-дезоксикортизола в кортизол. Снижение уровня кортизола в плазме вызывает выброс АКТГ из кортикотропных клеток гипофиза и накопление 11-дезоксикортизола в сыворотке.
Все 3 перечисленных теста долгое время использовались для дифференциальной диагностики АКТГ-зависимых форм СК, однако в многочисленных исследованиях была показана их недостаточная информативность [13].
Комбинированный тест с введением 10 мкг десмопрессина и 100 мкг КРГ первоначально давал многообещающие результаты [27], однако результаты недавнего исследования S. Tsagarakis и соавт. по оценке данного теста у 26 пациентов c БК и у 5 пациентов с АКТГ-эктопированным синдромом показали его недостаточную информативность [28]. Низкая эффективность перечисленных стимуляционных проб, вероятно, обусловлена экспрессией рецепторов к вазопрессину и рецепторов, стимуляция которых вызывает выброс СТГ, в некоторых АКТГ-продуцирующих эктопических опухолях.
Селективный забор крови из нижних каменистых синусов [13, 29] считается наиболее точным методом дифференциальной диагностики АКТГ-зависимых форм гиперкортицизма. По данным систематического анализа 21 исследования, включавшего 569 пациентов, этот метод позволяет добиться 96% чувствительности (4% ложноотрицательных результатов) и 100% специфичности (отсутствие ложноположительных результатов) в дифференциальной диагностике БК и АКТГ-эктопического синдрома. Исследование проводят путем катетеризации правого и левого каменистого синусов через бедренную артерию и измерения концентрации АКТГ в каждом из синусов и на периферии на –5, 0 минутах до и на 3, 5, 10-й минутах после введения КРГ в дозе 1 мкг/кг или 100 мкг внутривенно. У больных с БК градиент концентрации АКТГ центр/периферия составляет >2, а при АКТГ-эктопическом синдроме <2. После стимуляции это отношение у больных с БК возрастает >3, а при АКТГ-эктопическом синдроме не превышает 2.
Помимо дифференциальной диагностики различных форм АКТГ-зависимого гиперкортицизма, в некоторых случаях забор крови из нижних каменистых синусов может помочь в определении локализации аденомы гипофиза у пациентов с БК без визуализации аденомы на МРТ. Максимальный градиент между правым и левым синусом ≥ 1,4 до или после стимуляции КРГ дает информацию о стороне поражения, а градиент <1,4 указывает на срединное расположение кортикотропиномы с точностью до 70%. Основная причина ошибки — асимметричный венозный отток от гипофиза, который встречается в 40% случаев. Точность методики значительно повышается, если при ангиографическом исследовании получен результат симметричного венозного оттока.
Топическая диагностика.
Ее проведение оправдано после лабораторного подтверждения ЭГ у пациента.
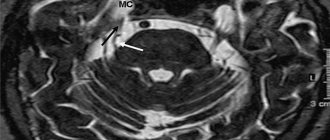
Для диагностики кортикостеромы или уточнения состояния надпочечников при других формах ЭГ необходимо проводить КТ/МРТ забрюшинного пространства. У всех пациентов с АКТГ-зависимой формой гиперкортицизма необходимо проводить МРТ головного мозга с контрастированием. Данная методика позволяет визуализировать аденому гипофиза у 2/3 пациентов с БК. КТ головного мозга менее чувствительна при наличии микроаденом <5 мм.
При подозрении на АКТГ-эктопический синдром проводят поиск места локализации опухоли: КТ/МРТ легких, средостения, брюшной полости, УЗИ щитовидной железы, малого таза, простаты, яичек, эзофагогастродуоденоскопия, колоноскопия; проведение сцинтиграфии рецепторов к соматостатину с использованием октреотида-In111, позитронно-эмиссионная томография с 5-гидрокситриптофаном, 18-дезоксифторглюкозой. Дополнительную помощь может оказать измерение биологических маркеров нейроэндокринных опухолей, таких как 5-гидроксииндолуксусная кислота, хромогранин А, серотонин, соматолиберин, катехоламины, кальцитонин (см. схему).
Дополнительные обследования
[2, 5, 6]. При установленном диагнозе ЭГ для уточнения тяжести метаболических нарушений и поражения других органов и систем необходимо проведение клинического анализа крови (для гиперкортицизма характерны лейкоцитоз с относительной лимфопенией, эозинофилопенией; незначительный эритроцитоз), клинического анализа мочи, биохимического анализа крови (повышение содержания липопротеинов низкой, очень низкой и высокой плотности, триглицеридов), определение гликемии, по показаниям — проведение перорального теста на толерантность к глюкозе, денситометрии, рентгенологического исследования грудного и поясничного отделов позвоночника в боковой проекции, ЭКГ, эхокардиографии, консультации кардиолога, гинеколога у женщин.
Субклинический гиперкортицизм (пре-Кушинг синдром, ССК)
Проблема впервые выявленных образований надпочечников и гиперкортицизма наиболее актуальна с точки зрения субклинического варианта этого заболевания, который встречается у 5—20% больных с инциденталомой надпочечника.
ССК характеризуется автономным (АКТГ-независимым) синтезом кортизола у пациентов в отсутствие клинических признаков гиперкортицизма. Данные лабораторных анализов чаще всего отражают незначительные изменения ритма секреции кортизола. Однако ССК должен быть исключен в каждом случае, если пациенту планируется хирургическое лечение, чтобы избежать послеоперационного адиссонического криза из-за возможного подавления функциональной активности контралатерального надпочечника.
По данным ряда исследований, несмотря на отсутствие типичных клинических проявлений, у пациентов с ССК значительно чаще выявляются избыточная масса тела, АГ, СД, репродуктивные расстройства и остеопороз [7, 30—32].
Таким образом, можно выделить следующие особенности ССК:
— автономная продукция кортизола без классических клинических симптомов («больших признаков») гиперкортицизма;
— как правило, сочетается с наличием образования в надпочечниках;
— встречается в 5—20% всех образований надпочечников;
— высокая частота артериальной гипертензии (АГ), ожирения, СД;
— в 1,5% случаев переходит в развернутый СК в течение года, в течение 5 лет наблюдения — у 25% больных;
— уровень кортизола в суточной моче нормальный (не всегда);
— диагностические критерии: отсутствие подавления кортизола в ходе подавляющих тестов с дексаметазоном;
— ССК необходимо исключать в каждом случае обследования пациента с образованием надпочечника(ов).
Диагностика и дифференциальная диагностика ССК
В качестве первичного теста, подтверждающего ЭГ у пациентов с образованием надпочечников, рассматривается ПТД1. Уменьшение утренней секреции кортизола менее нижней границы нормы, используемой в данной лаборатории (обычно менее 3—5 мкг/дл или 100—140 нмоль/л либо менее 1,8 мкг/дл или 50 нмоль/л), исключает автономный характер секреции кортизола опухолью. Как дополнительный метод — ПТД2. Вторым этапом обследования в отсутствие подавления кортизола является проведение БДП (8 мг дексаметазона). Если уровень кортизола вновь не подавляется, ставят диагноз ССК. Для подтверждения автономной функции опухоли также используются исследование АКТГ, вечернего кортизола в слюне или крови в 23.00 [4, 7, 33—36].
Лечение
Предпочтительный метод лечения при кортикостероме — адреналэктомия с опухолью. В качестве предоперационной подготовки используют ингибиторы стероидогенеза (производные аминоглютетимида — ориметен, маммомит 250—2000 мг/сут, под контролем уровня свободного кортизола в моче), производные кетоконазола (низорал 200—400 мг/сут); необходимо проводить лечение АГ, СД, сопутствующих инфекционных заболеваний (чаще всего пиелонефрита), проявлений остеопороза. При явлениях надпочечниковой недостаточности после адреналэктомии назначают заместительную терапию ГКС.
До настоящего времени обсуждается необходимость хирургического лечения при ССК, так как заболевание переходит в манифестную форму только у небольшого числа пациентов. При ССК автономная гиперсекреция кортизола опухолью может быть невысока при одновременной супрессии второго надпочечника. Поэтому у данной группы пациентов после хирургического лечения метаболические показатели (в том числе кортизол) могут изменяться незначительно. Однако есть исследования, по результатам которых у прооперированных пациентов с ССК отмечались снижение массы тела, улучшение течения АГ и СД. При подтверждении ССК в ходе проб с дексаметазоном адреналэктомия рекомендуется молодым пациентам (моложе 50 лет), пациентам с метаболическими расстройствами, причиной которых может быть образование в надпочечнике, такими как ожирение, АГ, СД, или при выявлении остеопороза либо остеопении. Необходимо помнить о возможном развитии надпочечниковой недостаточности при ССК после хирургического лечения (табл. 4) [7, 31, 33, 34, 37—40].
Прогноз
Успех и прогноз качества жизни пациентов после операции зависят от причины гиперкортицизма, своевременности его диагностики и наличия осложнений заболевания. В послеоперационном периоде эффективность лечения оценивают по степени регрессии симптомов СК: нормализации массы тела, АД, репродуктивной функции; контролируют уровни кортизола в моче, слюне, повторно проводят ПТД1. В исследованиях I. Bourdeau (2002), A. Hermus (1995) [42, 43] показано, что после успешно проведенной операции по поводу СК регрессируют когнитивные расстройства, возрастает минеральная плотность костной ткани, однако полной нормализации данных показателей у всех пациентов не происходит; качество жизни улучшается, однако остается ниже, чем у сопоставимых по возрасту и полу лиц без СК в течение 15-летнего наблюдения [42—44].
В настоящее время не выработана единая тактика ведения пациентов с ССК в связи с ограниченными данными исследований о снижении риска смерти у таких пациентов после хирургического лечения.
Учитывая, что для СК характерно прогрессирующее течение с постепенным развитием характерных тяжелых инвалидизирующих осложнений, логично предположить, что только своевременная постановка диагноза и адекватное лечение способны повысить качество жизни пациентов и снизить риск смерти.
Виды
Избыточный синтез глюкокортикоидов происходит под влиянием кортикотропина и кортиколиберина или независимо от них. В связи с этим выделяют АКТГ-зависимые и АКТГ-независимые формы патологии. К первой группе относятся:
- Центральный гиперкортицизм.
- АКТГ-эктопический синдром.
В медицине различают три вида гиперкортицизма, которые основываются на разнице причин возникновения патологии:
- экзогенный;
- эндогенный;
- псевдо-синдром.
Во врачебной практике также встречаются случаи юношеского синдрома гиперкортицизма. Юношеский выделен в отдельный вид и обусловлен возрастными гормональными изменениями в организме подростка.
Экзогенный
Под влиянием внешних причин, таких как применение для лечения лекарственных средств, содержащих глюкокортикоиды может развиться ятрогенный или экзогенный гиперкортицизм. В основном он проходит после отмены провоцирующего патологию лекарства.
Эндогенный
Факторами развития эндогенного гиперкортицизма могут быть следующие причины:
- опухоли гипофиза (микроаденома гипофиза);
- бронхов;
- опухоли яичек, яичников;
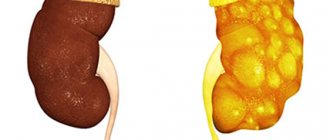
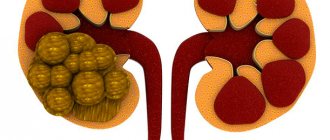
- опухоль или гиперплазия коры надпочечников.
Провоцирующей опухолью бронхов или половых желез чаще всего бывает эктопированная кортикотропинома. Именно она вызывает повышенную секрецию кортикостероидного гормона.
Псевдо-синдром
Неистинный гиперкортицизм возникает по следующим причинам:
- алкоголизм;
- беременность;
- прием оральных контрацептивов;
- ожирение;
- стрессы или затяжные депрессии.
Наиболее часто причиной псевдо-синдрома становится сильное отравление организма алкоголем. При этом любые опухоли отсутствуют.
Как может протекать синдром?
Патология может быть скрытой, при слабом повышении синтеза гормона, и ярко выраженной. Медики выделяют три формы проявления недуга:
- Субклинический гиперкортицизм, встречается на раннем этапе или при малых формах опухолей, проявляется повышенным АД, нарушением функции половых желез.
- Ятрогенный возникает вследствие воздействия лекарственного препарата для лечения ревматических заболеваний, крови. При трансплантологии органов выявляется в 75% случаев.
- Функциональный или эндогенный гиперкортицизм выявляется при серьезных патологиях гипофиза, при сахарном диабете. Особого наблюдения требуют пациенты с юношеским синдромом Иценко-Кушинга.
До 65% случаев приходится на ятрогенный гиперкортицизм.
Симптомы гиперкортицизма у женщин и мужчин
Клиническая картина гиперкортицизма характеризуется симптомами:
- прогрессирующая слабость;
- постоянная утомляемость;
- бессонница;
- усталость;
- гипотония;
- психическая астения;
- отсутствие аппетита;
- тошнота;
- рвота;
- запоры,
- сменяющиеся поносами;
- боли в животе;
- снижение массы тела.
Патологическое увеличение показателя глюкокортикоидов приводит к появлению синдрома гиперкортицизма. Пациенты утверждают о жалобах, связанных с изменением внешности и сбоем функционирования сердечно-сосудистой системы, а также костно-мышечной, репродуктивной, нервной систем. Клинические проявления заболевания также вызваны повышенным содержанием альдостерона и андрогенов, вырабатываемых надпочечников.
Симптомы у женщин
Гиперкортицизм у женщин проявляется следующими симптомами:
- гирсутизмом;
- вирилизацией;
- гипертрихозом;
- сбоем менструальных циклов;
- аменореей и бесплодием.
Самым «популярным» проявлением гиперкортицизма со стороны опорно-двигательного аппарата является остеопороз (он обнаруживается у 90 % людей, страдающих синдромом). Данная патология имеет свойство прогрессировать: сначала она дает знать о себе болью в суставах и костях, а затем – переломами рук, ног и ребер. Если остеопорозом страдает ребенок, у него наблюдается отставание от сверстников в росте.
Признаки у мужчин
Мужской гиперкортицизм проявляется проблемами в половой системе: снижением потенции и либидо, атрофией яичек и гинекомастией. Так же, гиперкотицизм может проявить себя сбоями нервной и сердечно-сосудистой систем.
“Нервные” симптомы:
- психозы и стрессы;
- смена эйфорического состояния депрессией;
- заторможенность;
- суициидальные попытки.
Сердечно-сосудистые симптомы:
- аритмия сердца;
- артериальная гипертония;
- сердечная недостаточность.
Кожа у пациентов имеет характерный «мраморный» оттенок с хорошо заметным сосудистым рисунком, склонна к шелушению, сухости, перемежается с участками потливости. На коже плечевого пояса, молочных желез, живота, ягодиц и бедер образуются полосы растяжения кожи – стрии багровой или цианотичной окраски, длиной от нескольких миллиметров до 8 см и шириной до 2 см. Наблюдаются кожные высыпания (акне), подкожные кровоизлияния, сосудистые звездочки, гиперпигментация отдельных участков кожи.
Негативно сказывается синдром на гормональном фоне пациента, наблюдается нестабильное эмоциональное состояние: депрессия чередуется с эйфорией и психозом.
Основные симптомы, указывающие на патологию
Гиперкортицизм у больных проявляется такими симптомами:
У такой патологии много симптомов, на которые человек должен обратить внимание.
- накопление жировой клетчатки в верхней части тела;
- лицо круглой формы;
- тонкие верхние и нижние конечности;
- стрии на теле;
- сниженное настроение;
- раздражительность;
- румянец на лице;
- скачки давления;
- сбои в работе сердца;
- рост волос у женского пола по мужскому типу;
- изменение менструального цикла;
- развитие остеопороза;
- сильная усталость;
- появление атрофии мышц;
- головные боли.
Гиперкортицизм у детей проявляется такой симптоматикой:
- увеличение массы тела;
- повышение давления;
- появление остеопороза;
- изменения кожных покровов;
- развитие энцефалопатии;
- ухудшение обменных процессов в организме;
- неравномерное отложение жира на теле;
- увеличение лица;
- избыточный рост волос;
- появление стрий;
- поражение мышечного слоя.
Осложнения
Одним из самых опасных осложнений гиперкортицизма является адренолиновый криз, который проявляется:
- нарушением сознания;
- рвотой и высоким давлением;
- гиперкалиемией;
- гипонатриемией;
- гипогликемией;
- болями в животе;
- метаболическим ацидозом.
Синдром Кушинга, который перешел в хроническую форму способен привести к гибели человека, поскольку провоцирует ряд тяжелых осложнений, а именно:
- декомпенсация сердца;
- инсульт;
- сепсис;
- пиелонефрит тяжелой степени;
- недостаточность почек хронической формы;
- остеопороз, при котором происходят многочисленные переломы позвоночника.
Прогноз
Прогноз определяется формой гиперкортицизма и адекватностью проведенного лечения. При своевременном и правильном лечении прогноз благоприятный, однако тяжесть гиперкортицизма определяет степень негативности прогноза.
Основные риски негативного прогноза:
- возможное развитие и прогрессирование сердечно-сосудистой патологии (инфаркт, инсульт, недостаточность кровообращения);
- остеопороз с компрессией тел позвонков, патологические переломы и нарушения двигательной активности вследствие миопатии;
- сахарный диабет с его «поздними» осложнениями;
- иммуносупрессия и развитие инфекций и/или сепсиса.
С другой стороны, прогноз при опухолевых формах гиперкортицизма зависит от стадии опухолевого процесса.
Диагностика
Для диагностики данного заболевания используют следующие методы:
- анализ крови на адренокортикотропный гормон и кортикостероиды;
- гормональные пробы мочи;
- рентген головы, костей скелета;
- МРТ или КТ головного мозга.
Диагноз ставится четко при наличии всех исследований. Его следует дифференцировать с сахарным диабетом и ожирением.
Ни один из лабораторных диагностических тестов на гипер-кортизолизм нельзя считать абсолютно надёжным, поэтому часто рекомендуют их повторять и комбинировать. Диагноз гиперкортицизма устанавливают на основании повышенной экскреции свободного кортизола с мочой или нарушенной регуляции гипоталамо-гипофизарно-надпочечниковой системы:
- суточная экскреция свободного кортизола и 17-гидроксикортикостерона повышена;
- суточный биоритм секреции кортизола отсутствует;
- содержание кортизола в 23—24 ч повышено.
Исследования в амбулаторных условиях
- Свободный кортизол в суточной моче. Доля ложноотрицательных результатов в этом тесте достигает 5-10%, поэтому исследование рекомендуют проводить 2—3 раза. Ложноположительные результаты также провоцируют приём фенофибрата, карбамазепина и дигоксина, а ложноотрицательные результаты возможны при сниженной клубочковой фильтрации (<30 мл/мин).
- Ночной дексаметазоновый тест. Ложноотрицательные результаты (т.е. отсутствие снижения кортизола) наблюдаются у 2% здоровых людей и возрастают до 20% у пациентов с ожирением и среди госпитализированных больных.
Если в обоих указанных выше тестах не подтверждается гиперкортизодизм, его наличие у больного маловероятно.
Патогенез
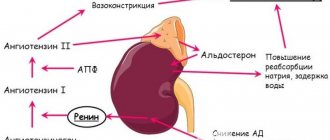
Основные эффекты избытка глюкокортикоидов:
- со стороны сердечно-сосудистой и мочевыделительной систем — повышенная активация ренина в почках, гиперстимуляция синтеза ангиотензина в печени, излишняя задержка воды и натрия, избыточная потеря калия, поражение почечных канальцев, диастолическая АГ, изменение сосудистой реактивности и повышение сосудистого тонуса, потенцирование глюкокортикоидами прессорного эффекта катехоламинов и других биогенных аминов;
- со стороны нервной и гипоталамо-гипофизарной систем — вегетативная дистония, подавление секреции гонадотропных гормонов, гормона роста, ТТГ, атрофия головного мозга;
- со стороны психоэмоциональной сферы — депрессия, психоз, эйфория в результате неадекватной выработки эндорфинов, апатия;
- со стороны обмена белков и состояния соединительной ткани — усиленный катаболизм белков, распад коллагеновых волокон;
- со стороны жирового и углеводного обмена — инсулинорезистентность и гиперинсулинемия, гиперглюкагонемия, повышенное накопление гликогена в печени, усиление липолиза, увеличение висцеральной жировой ткани, повышение содержания общего холестерина и триглицеридов, снижение содержания ЛПНП;
- со стороны костной системы и минерального обмена — подавление костеобразования, усиление костной резорбции, деградация костного матрикса (уменьшение содержания органических веществ — коллагена и мукополисахаридов), избыточное выведение кальция с мочой, торможение процессов гидроксилирования кальциферола, снижение концентрации активных метаболитов витамина D в крови, снижение абсорбции кальция в кишечнике, подавление продукции остеокальцина;
- со стороны иммунной системы и крови — нейтрофилез, лимфоцитопения, тромбоцитоз, иммуносупрессия.
Лечение
На основании данных, полученных в ходе диагностики, врач может предложить один из трех методов лечения гиперкортицизма:
Лекарственные препараты
Препараты могут назначаться как самостоятельно, так и в составе комплексной терапии. Основу медикаментозного лечения гиперкортицизма составляют лекарственные средства, действие которых направлено на снижение выработки гормонов в надпочечниках. К подобным медикаментам относятся такие препараты, как Метирапон, Аминоглютетимид, Митотан либо Трилостан. Обычно их назначают при наличии противопоказаний к остальным методам лечения и в тех случаях, когда эти методы (например, оперативный) оказались неэффективными
Лучевая терапия
Лучевую терапию назначают в том случае, когда синдром спровоцирован аденомой гипофиза. В таком случае оказывается на пораженную область лучевое воздействие, что провоцирует понижение выработки адренокортикотропного гормона. Вместе с лучевой терапией применяется медикаментозное или хирургическое лечение. Таким образом, удается добиться максимально позитивного результата в лечении гиперкортицизма.
Хирургическое вмешательство
Гипофизный синдром Кушинга на поздних этапах нуждается в оперативной терапии. Больному назначают транссфеноидальную ревизию гипофиза и устраняют аденому посредством микрохирургической техники. Этот терапевтический метод приносит наибольший эффект и отмечается быстрым улучшением состояния после проведения операции. В тяжелых случаях при хирургическом вмешательстве больным удаляют два надпочечника. Таким пациентам показан пожизненный прием глюкокортикоидов.
От чего зависит эффективность лечения?
У гиперкортицизма может быть стремительное развитие, то есть все симптомы появляются в течении 6-12 месяцев и может быть постепенное развитие клинической картины в течении 3-10 лет. Лечение будет зависеть от правильной диагностики, от тяжести заболевания и от быстроты развития симптоматики. Лечение должно быть нацелено на устранение клинических проявлений и нормализацию уровня кортизола.
При средней и легкой степени тяжести применяются лекарственные препараты, которые не будут давать организму вырабатывать лишнее количество гормонов надпочечников или назначается лучевая терапия, которая снижает активность гипофиза. Если это всё не дает должного эффекта, то применяют хирургическое лечение. В процессе такого вмешательства опухоль гипофиза удаляют. Либо проводится адреналэктомия, то есть устранение одного из надпочечников, но после такой операции необходима постоянная заместительная терапия.
Выводы
Хирургическое вмешательство считается ведущим методом лечения для удаления опухоли, вызывающей гиперкортицизм. Но оно может сопровождаться побочными эффектами. Аналогичное можно сказать и про лучевую терапию с приемом лекарств, влияющих на надпочечники.
Эти методы лечения — единственный вариант для людей с прогрессирующей болезнью Кушинга. Но синдром гиперкортицизма или просто высокий уровень кортизола возможно снизить более безопасными методами. Для этого необходимо внести изменения в свой образ жизни.
К примеру, заняться спортом, медитацией, больше спать и придерживаться определенной диеты. В качестве пищевых добавок можете попробовать:
- Витамин С — 3000 мг в день;
- DHEA — 50 мг в день;
- Пантотеновую кислоту (витамин В5) — 1500 мг в день;
- Мелатонин – от 300 мкг до 6 мг (перед сном);
- Фосфатидилсериновые капсулы — 300 мг в день.
- Солодка (Glycyrrhiza glabra) — не более 1000 мг глицирризина.
Но, учтите, что прием этих веществ обязательно нужно согласовать с лечащим врачом. Не занимайтесь самолечением, чтобы еще больше себе не навредить.