Почечная гипертензия – это гипертония (высокое давление), развившаяся в результате повреждения почек. Речь идет о гипертонической почечной недостаточности. Гипертония этого типа является наиболее распространенной формой вторичной гипертензии. 4-5% всех пациентов с гипертонией (высоким давлением) имеют паренхиму почек и 1-2% – стенотическую болезнь почек.
Распространенность этого типа гипертензии повышается с возрастом, с продолжительностью нефропатии и снижением основной функции почек.
Этиология и патогенез
Повышенное артериальное давление традиционно считается уделом тех, кого постигла какая-либо сердечно-сосудистая патология. Непосвященному человеку гипертония почечного происхождения кажется чем-то совершенно необычным. Казалось бы, при чем здесь органы мочевыделительной системы, если за перекачку крови в организме отвечает сердце? По мнению ученых, в этом нет абсолютно ничего удивительного, ведь давление — это результат взаимозависимого функционирования сердечной мышцы, сосудов и почек.
В ходе эволюционного процесса этот парный фасолевидный орган принял на себя функцию регулятора одного из важнейших показателей состояния кровеносной системы. В противном случае почки попросту бы не смогли очищать поступающую в организм жидкость.
Если в этом механизме внезапно происходит сбой и давление снижается, в кровяное русло выбрасывается порция ренина — полипептидного гормона, преобразующегося в ангиотензин, который ответственен за сужение сосудов и выработку альдостерона — вещества, задерживающего в организме жидкость и натрий. Возникает опасная для жизни ситуация, при которой объем сосудистого русла не соответствует уровню циркулирующей крови. Среди причин, способствующих развитию почечной артериальной гипертензии следует выделить:
- Патологии нефрологического характера (хроническая форма пиелонефрита, мочекаменная болезнь, гломерулонефрит, гнойное поражение околопочечной клетчатки).
- Эндокринные заболевания (наибольшую угрозу представляет сахарный диабет).
- Врожденные сосудистые патологии почек (аневризма аорты, коарктация, разрастание артерий).
- Приобретенные заболевания кровеносной системы паренхиматозных органов (закупорка сосудов, склеротические изменения).
- Пороки развития (гормонально-активная опухоль надпочечников, удвоение почки).
- Стрессовые ситуации (сильное эмоциональное напряжение нередко провоцирует нарушения в работе мочевыделительной системы).
- Неправильное питание (особенно опасен избыток соли в рационе).
Что такое почечное давление
Почечное давление – это диастолический показатель АД, значение которого отклоняется от норматива в результате сбоев в работе системы почек. Диагностируется болезнь у 20-30% гипертоников.
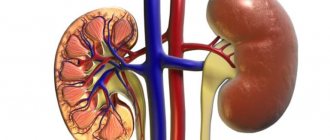
Почки осуществляют фильтрацию крови, выводят избыточное количество жидкости, продукты распада и вредные вещества, случайно попавшие в кровоток.
Нормальное и нарушенное кровоснабжение почки
При нарушении водно-электролитного баланса и угнетения депрессорной системы орган начинает функционировать неправильно: приток плазмы снижается, вода и натрий задерживаются, провоцируя отечность. Из-за избытка ионов натрия разбухают стенки артерий. Сосуды становятся более чувствительными.
Почечные рецепторы начинают синтезировать избыточное количество фермента ренин, который трансформируется в ангиотениз, а потом – в альдостерон. Эти элементы отвечают за сосудистый тонус, уменьшают просвет артерий и приводят к росту давления.
В норме нижнее (почечное) давление находится в пределах 60-90 мм рт. ст.
Верхний показатель тонометра при этом не должен превышать отметку 140 мм рт. ст. При гипертензии почечного генеза АД может повышаться до 250/150-170 мм рт. ст.
Разница между составляет от 100 до 120 единиц.
Главным признаком почечного давления выступает неэффективность гипотензивных препаратов. Это объясняется специфическим регуляторным механизмом.
Некоторые нарушения фильтрующего органа могут провоцировать уменьшение цифр тонометра. Но такой симптом встречается крайне редко.
Классификация патологии
По характеру течения нефрогенная гипертония может быть как доброкачественной природы, так и злокачественной. В зависимости от этиологических факторов различают три формы артериальной гипертензии почечного генеза:
- Паренхиматозная. Возникает на фоне поражения тканей почек. Чаще всего регистрируется у лиц, страдающих сахарным диабетом, туберкулезом, гломерулонефритом.
- Вазоренальная (реноваскулярная). Повышению давления способствует изменение просвета почечных артерий. В группу риска автоматически попадают люди, у которых был обнаружен тромбоз, атеросклероз, аневризма. Этот вид ренальной гипертензии часто наблюдается у детей до 14 лет.
- Смешанная. Развивается вследствие поражения паренхимы почек в сочетании с сосудистыми патологиями. Заболеванию в большей степени подвержены пациенты с врожденными аномалиями, опухолями и кистозными образованиями.
Причины и механизм развития
Факторов, воздействующих на состояние и работу сердечно-сосудистой системы довольно много. Большинство из них может привести к повышению или понижению АД.
По отношению к почечной гипертензии выделяют 3 основные причины:
- Задержка ионов натрия и воды – обычный механизм формирования гипертензии при поражении паренхимы. При увеличении количества приходящей крови, в конце концов, приводит к нарушению фильтрации и своеобразному внутреннему отеку. Увеличивается объем внеклеточной жидкости, который провоцирует увеличение АД. Вместе с водой задерживаются ионы натрия.
В ответ увеличивается выработка дигиталисподобного фактора, который уменьшает реабсорбцию натрия. Но при заболевании почек гормон вырабатывается чересчур активно, что приводит к гипертонусу сосудов и, соответственно, повышает давление.
- Активизация РААС ренин-ангиотензин-альдостероновой системы. Ренин – один из гормонов, способствующих расщеплению белка, и сам по себе на состояние сосудов влияния не оказывает. Однако при сужении артерий выработка ренина увеличивается.
Гормон вступает в реакцию с α-2-глобулином, вместе с которым и образует чрезвычайно активное вещество – ангиотензин-II. Последний заметно повышает величину АД и провоцирует усиленный синтез альдостерона.
Клиническая картина
Симптомы почечной гипертензии суммируются из признаков, характерных для артериальной гипертонии и заболеваний органов мочевыделительной системы. Выраженность патологического процесса и степень его внешнего проявления напрямую зависят от того, с какой клинической формой болезни приходится иметь дело. Типичными симптомами стойкого повышения давления, обусловленного проблемами с почками, являются:
- сильная головная боль;
- учащенный пульс;
- беспричинная слабость;
- стеноз почечной артерии;
- появление плавающих точек перед глазами;
- частое мочеиспускание;
- отечность тела;
- болевой синдром в области поясницы.
Между злокачественным и доброкачественным течением нефрогенной гипертензии существуют некоторые отличия. Агрессивная форма заболевания, как правило, развивается молниеносно. Диастолический показатель давления может подскочить до отметки в 120 мм рт. ст. и практически сравняться с систолическим. Человека беспокоят мучительная головная боль в затылочной области, головокружение, тошнота, повышение температуры тела. Из-за поражения зрительного нерва возникает расфокусировка зрения.
Доброкачественная почечная гипертензия отличается медленным развитием. Для нее присущ равномерный рост артериального давления. Пациент жалуется на общее недомогание, одышку, давящую головную боль и пульсацию в груди, вызванную ускорением сердечного ритма.
Лечение
Лечебные методы зависят от формы гипертензии, тяжести, стадии и степени заболевания, выявленного в процессе диагностики. Прежде чем лечить почечную гипертонию, следует провести обследование надпочечников.
Выделяют три основных стадии гипертензии:
- Транзиторная. Один из признаков – периодическое повышение артериального давления. Нарушения в сердце поддаются коррекции.
- Течение стойкой (стабильной) стадии гипертензии течение характеризуется высоким давлением. Анатомические нарушения сердца и почек четко обозначены.
- При злокачественной стадии гипертензии показатели артериального давления редко опускаются ниже 170 мм ртутного столба. Происходит поражение мозга, сердца и глазного дна.
Важно! Терапию назначает только врач. Самостоятельное лечение абсолютно не допустимо.
Лечение гипертонии при почечной недостаточности обуславливается выявленными симптомами и результатами диагностики.
Диагностические процедуры
Первый этап диагностики предусматривает тщательный общеврачебный осмотр, а также целенаправленное ознакомление с жалобами пациента и сбор анамнестических данных. В постановке диагноза важная роль отводится измерению артериального давления на верхних и нижних конечностях, аускультации сердечной мышцы и крупных артерий.
В обязательном порядке проводятся общий и биохимический анализы крови. Последний необходим для определения количественного содержания в кровяной массе электролитов, мочевины и креатинина. Также выполняют общий анализ мочи, пробы (по Зимницкому и Каковского-Аддиса), бактериологическое исследование урины.
Выявить первопричину повышенного давления позволяют такие инструментальные методы диагностики, как ультразвуковое исследование паренхиматозных органов и динамическая сцинтиграфия почек. Обнаружение поврежденных почечных сосудов осуществляется посредством традиционной аортрографии, селективной или цифровой субтракционной ангиографии.
На финальном этапе, чтобы уточнить природу гипертонии, определить функциональную значимость пораженных артерий, а также выработать оптимальную интраоперационную тактику, пациенту требуется пройти радиоиммунологическое исследование уровня ренина в крови, взятой из почечной вены. В последнее время для диагностики вазоренальной гипертензии все чаще используется фармакорадиологичеческая проба с Каптоприлом.
Постановка диагноза
Обследование: значительно более высокие цифры артериального давления, чем при гипертензии. Диастолическое давление повышено больше. В результате уменьшается разница между верхним и нижним давлением – пульсовое давление.
Характерный симптом вазоренальной гипертензии: при аускультации (выслушивании) области выше пупка, слышен систолический шум, который проводится в боковые части живота и назад, в область рёберно–позвоночного угла. Он возникает при стенозе почечных артерий, при ускорении кровотока через узкий участок в фазу сокращения сердца. Аневризма почечной артерии даёт систоло-диастолический шум той же локализации, ток крови образует завихрения в зоне расширения сосуда в обе фазы – сокращения и расслабления. Отличить систолический шум от диастолического можно, если во время аускультации держать руку на пульсе – в прямом смысле. Систолический шум соответствует пульсовой волне, диастолический слышен во время паузы между ударами.
Изменения сосудистого рисунка глазного дна: сетчатка отёчна, центральная артерия сужена, сосуды неравномерного диаметра, кровоизлияния. Быстро снижается зоркость и выпадают поля зрения.
УЗИ: получают данные о размерах и строении почек, возможных отклонениях развития. Обнаруживают опухоли и кисты, признаки воспаления.
УЗ допплер-ангиография: вводится контрастное вещество, позволяющее оценить почечный кровоток. Допплер-эффект основан на степени отражения ультразвука от структур различной плотности, в данном случае при его помощи определяют состояние стенок почечной артерии.
Урография: после введения контраста делают серию наблюдений, определяя скорость распределения вещества в почках. При реноваскулярной форме почечной гипертензии контрастирование замедлено в начале, в течение 1-5 минут от начала процедуры, и усиливается на 15–60-й минутах.
Динамическая сцинтиграфия: внутривенно вводят радиоизотоп, при стенозе почечной артерии он достигает почки медленнее, чем в норме.
Почечная ангиография: ведущий метод по определению локализации, вида и протяжённости изменений в почечных артериях. Визуализация аневризмы либо стеноза и определение его степени; расположение артерий и их дополнительных ветвей; распределение контраста в почках, их величина и положение – спектр диагностической ценности исследования. Во время ангиографии, при обнаружении стеноза почечных артерий, проводят рениновый тест (разница содержания ренина в периферической и крови, оттекающей от почек), доказывающий или опровергающий диагноз реноваскулярной гипертензии.
МРТ и спиральная компьютерная томография: позволяют провести надёжные и информативные обследования, получить послойные изображения почек и сосудов.
Биопсия: берётся небольшой участок ткани почки, подготавливается для микроскопического исследования. По результатам уточняют степень тяжести болезни и дальнейший прогноз.
Терапевтическая стратегия
Лечение почечной гипертонии, симптомы которой схожи с гипертонической болезнью, преследует цель нормализовать артериальное давление и замедлить прогрессирование почечной недостаточности, тем самым улучшив самочувствие больного и увеличив продолжительность жизни. Впервые выявленное нефрогенное заболевание или подозрение на него — прямое показание к госпитализации в больницу для уточнения этиологического фактора повышенного давления.
Медикаментозное лечение
Фармакотерапия должна подбираться исключительно врачом. Лекарственные средства нужны для приведения давления в норму и улучшения функционального состояния почек. Даже с учетом того, что для лечения патологии используют традиционные гипотензивные препараты, без консультации нефролога их прием с большой долей вероятности не окажет должного терапевтического эффекта. В стандартную схему терапии гипертензии почечного генеза включают следующие группы лекарств:
- бета-блокаторы (Атенолол, Метопролол, Небиволол);
- ингибиторы АПФ (Каптоприл, Эналаприл, Фозиноприл);
- мочегонные средства (Фуросемид, Индапамид, Спиронолактон);
- антагонисты кальциевых каналов (Верапомил, Дилтиазем, Лацидипин).
Бета-блокаторы нейтрализуют действие адреналина и норадреналина на особые рецепторы в сердце, в результате чего снижается частота сердечных сокращений и артериальное давление стабилизируется. Ингибиторы ангионтензинпревращающего фермента снижают выработку основного минералокортикостероидного гормона коры надпочечников (альдостерона), что препятствует повышению тонуса сосудов.
Гипертоникам рекомендован курсовой прием этих препаратов. Дневную дозировку подбирают индивидуально, учитывая форму заболевания, возраст и вес больного. Благодаря пролонгированному действию такие таблетки позволяют держать давление под контролем в течение суток даже при одноразовом приеме.
Диуретики утилизируют лишнюю жидкость из организма, не позволяя образовываться отекам, улучшают работу почек и нормализуют давление. Антагонисты кальция защищают сердечную мышцу от дистрофических изменений. Для лечения нефрогенной гипертензии достаточно часто пациентам выписывают препараты на основе Амлодипина. Кроме того, ощутимую пользу в борьбе с недугом оказывают средства химического и растительного происхождения, которые призваны улучшать работу органов мочевыделительной системы.
Хирургическое вмешательство
Если бессолевая диета и прием лекарственных препаратов не приносят никакого результата, то целесообразно задуматься об операции. Оперативное вмешательство позволяет полностью восстановить проходимость сосудов. Современные клиники оснащены оборудованием, которое позволяет проводит высокотехнологичные операции с минимальным риском для здоровья. Отличные результаты в лечении почечной гипертензии демонстрируют следующие хирургические методики:
- Чрезкожная баллонная ангиопластика. Используя катетер, снабженный баллончиком, специалист расправляет стенозированные участки артерий. Очевидным плюсом такой манипуляции является тот факт, что пациент во время операции не находится под общим наркозом, а само вмешательство занимает совсем немного времени. В редких случаях возникают осложнения в виде разрыва сосуда или обострения кровотечения.
- Открытая ангиопластика. Суть операции заключается в удалении атеросклеротических бляшек и реконструкции пораженного участка почечной артерии, для чего используются собственные сосуды или протезы. Достоинство методики в том, что у пациента полностью восстанавливается кровоток и убираются отложения, провоцирующие воспалительную реакцию. Пожилой возраст следует рассматривать как противопоказание к операции, поскольку велика вероятность сердечно-сосудистых осложнений.
Артериальная гипертензия при хронической болезни почек: современное состояние проблемы
Резюме. Артериальная гипертензия (АГ) является значимой проблемой системы здравоохранения. Это основной модифицируемый фактор риска развития сердечно-сосудистых заболеваний (ССЗ), инсульта и почечной недостаточности. Длительная и устойчивая АГ ускоряет прогрессирование заболевания почек до терминальной стадии, а прогрессирующее снижение функции почек, наоборот, способствует повышению артериального давления (АД) и ухудшению его контроля. Хроническая болезнь почек (ХБП) является как распространенной причиной гипертонии, так и осложнением неконтролируемой АГ. АГ и ХБП тесно связаны смешанными причинно-следственными связями. Поскольку АГ может быть причиной и следствием ХБП, распространенность ее выше и контролировать ее сложнее. Взаимодействие между АГ и ХБП является сложным и повышает риск неблагоприятных сердечно-сосудистых и цереброваскулярных исходов. Патофизиология АГ при ХБП сложна и представляет собой следствие множества факторов, включая снижение массы нефронов, повышенную задержку натрия и расширение внеклеточного объема, гиперактивность симпатической нервной системы, активацию гормонов, включая ренин-ангиотензин-альдостероновую систему, и эндотелиальную дисфункцию. Пациенты с ХБП чаще имеют АГ высокого риска: скрытую, резистентную и ночную гипертензию. Настоящий обзор литературы посвящен современным представлениям о распространенности, патогенезе, течении, контроле, принципах лечения АГ при ХБП. Актуальность данной проблемы связана с ростом числа больных с АГ и ХБП во всем мире и их высокой заболеваемостью и смертностью. Двунаправленный характер взаимосвязи АГ и ХБП делает перспективным изучение этих двух состояний с целью замедления темпов прогрессирования почечной и кардиальной дисфункций.
В настоящее время хроническая болезнь почек (ХБП) признана всемирной эпидемией. ХБП приводит к терминальной стадии почечной недостаточности (ТПН) и требует значительных затрат здравоохранения. По мере снижения функции почек наблюдается рост артериальной гипертензии (АГ), сопутствующей ХБП [1, 2]. АГ – глобальная проблема медицины. Это основной модифицируемый фактор риска развития сердечно-сосудистых заболеваний (ССЗ) и инсульта. ХБП является как распространенной причиной АГ, так и ее осложнением при неконтролируемом течении. Взаимодействие между АГ и ХБП является сложным, что повышает риск неблагоприятных сердечно-сосудистых и цереброваскулярных исходов [3]. Частота встречаемости кардиальных и почечных осложнений обуславливает АГ и ХБП как значимые проблемы медицины [4–6].
Распространенность АГ составляет 25–30%, ХБП – 15% среди взрослого населения [1, 5].
Частота АГ у больных с ХБП значительно выше, чем в популяции. По оценкам эпидемиологических исследований 67–71% больных этой категории имеют АГ, а у пожилых она встречается в 82% случаев [1, 7]. На поздних стадиях ХБП АГ обнаруживается у 90% больных [8]. АГ широко распространена у получающих заместительную почечную терапию (ЗПТ) [5, 7]. Встречаемость АГ у пациентов на диализе варьирует из-за различий в методах контроля артериального давления (АД): до или после диализа либо амбулаторное. Согласно многочисленным исследованиям 50–60% (до 85%) пациентов, находящихся на гемодиализе, и почти 30% больных на перитонеальном диализе страдают АГ [9, 10]. Поскольку АГ может быть причиной и следствием ХБП, распространенность ее выше и контролировать ее сложнее. На распространенность, тяжесть и контроль АГ влияют: этиология ХБП, наличие и степень альбуминурии, генетические, социально-экономические факторы и образ жизни. Кроме того, существуют расовые и этнические различия в распространенности, лечении, рисках и исходах АГ у пациентов с ХБП [5].
Патофизиология АГ при ХБП
Причинно-следственная природа АГ и ХБП носит двунаправленный характер, это тесно взаимосвязанные патофи-зиологические состояния [11–13]. Пациенты с ХБП чаще имеют фенотипы АГ высокого риска, такие как скрытая, резистентная и ночная гипертензия. При скрытой АГ чаще встречаются повреждения органов-мишеней и иные неблагоприятные события. Недавние исследования показали, что скрытая АГ при ХБП связана с повышенным риском развития гипертрофии левого желудочка (ГЛЖ), протеинурии и снижения расчетной скорости клубочковой фильтрации (СКФ). Также скрытая АГ ассоциируется с высокой ССЗ, терминальной стадией ХПН и смертностью от всех причин. Требуется дальнейшее изучение скрытой АГ, поиск рациональных методов диагностики и лечения [12–14]. Резистентную АГ определяют, когда при использовании трех антигипертензивных препаратов разных классов в оптимальных дозах (один из которых диуретик) АД сохраняется выше целевого уровня при «офисном» и «внеофисном» контроле [14–17].
Патофизиология АГ при ХБП сложна, многофакторна и представляет собой следствие множества механизмов: снижение количества нефронов, повышенная задержка натрия и увеличение внеклеточного объема, активация симпатической нервной системы и ренин-ангиотензин-альдостероновой системы, эндотелиальная дисфункция [3, 12, 18]. В последние годы появилась новая информация о гомеостазе и регуляции натрия и воды. Обсуждаются мультиорганные эффекты вазопрессина, высокосолевой диеты, ограниченного потребления воды, а также значение накопления натрия и ритмичность его выведения с мочой. Получены данные о том, что дисрегуляция обмена натрия и воды может оказывать сильное воздействие на почки и сосуды. Дезадаптация к высокосолевой диете может быть связана с неуклонным ростом частоты АГ и ХБП [19]. Хорошо известна связь между препаратами эритропоэтина (ЭПА) и АГ при ХБП. Как показывают исследования, механизм этой связи многофакторный. Так, часть пациентов с ХБП имеют ограниченную способность приспосабливаться к быстрому увеличению объема эритроцитов из-за снижения СКФ, роста сосудистого сопротивления и наличия ГЛЖ. Кроме того, существует вероятность прямого сосудосуживающего эффекта и развития индуцированной ЭПА АГ. Рекомендуется соблюдать осторожность при применении ЭПА у пациентов с резистентной АГ и отслеживать скорость повышения гемоглобина при неконтролируемом АД [20]. К основным причинам АГ у пациентов на диализе относят: увеличение объема жидкости, симпатическую гиперактивность, активацию ренин-ангиотензин-альдостероновой системы, атеросклероз, воздействия вазоактивных пептидов, происходящих из эндотелия, увеличение внутриклеточного кальция и снижение фермента реналазы, выделяющегося почкой в ответ на выброс катехоламинов [21]. Хорошо известна связь между мочевой кислотой и системной гипертензией, заболеваниями почек и ССЗ. Недавние исследования подтверждают роль изменения активности некоторых ферментов, индуцируемых мочевой кислотой, в патогенезе АГ и ХБП [22]. Все больше появляется данных относительно участия микробиоты кишечника в регуляции АД и ухудшении прогноза ХБП. Так, например, при АГ снижается количество короткоцепочечных жирных кислот, что приводит к ухудшению микробного баланса, нарушению целостности эпителиального барьера и развитию воспаления кишечника. Эти изменения нарушают регуляцию АД и, как следствие, способствуют повреждению органов-мишеней, в том числе почек. С другой стороны, при ХБП накопление уремических токсинов в кишечнике вызывает изменения в составе его микробиоты и метаболитов, способствует транспорту эндотоксинов в кровоток, усиливает воспаление, повреждение почек и ухудшает прогноз ХБП [23].
Контроль и целевое АД у пациентов с ХБП
Несмотря на то, что осведомленность о лечении АГ у пациентов с ХБП улучшается, контроль АД на всех стадиях ХБП остается неоптимальным [5]. Для диагностики АГ могут применяться как случайные, так и амбулаторные измерения АД. Использование амбулаторного мониторинга обеспечивает дополнительную оценку суточных вариаций АД, обычно наблюдаемых при ХБП [3, 7]. Контролируют АД небольшой процент больных, это определяет недостаточную приверженность к лекарственным препаратам, неоптимальный контроль объемной перегрузки и, следовательно, недостаточное лечение [18]. Около 30–60% пациентов с АГ не достигают целевых показателей АД и остаются в группе риска повреждения органов-мишеней [17]. Однако контроль за АД в популяции больных ХБП позволяет снизить риск неблагоприятных сердечно-сосудистых и церебральных событий, летальность и прогрессирование почечной недостаточности [7, 12]. Большинство современных рекомендаций касаются интенсивного контроля АД и активного антигипертензивного лечения [12, 24]. Повышение качества ведения пациентов с АГ играет важную роль в замедлении прогрессирования, улучшении прогноза и предотвращении осложнений ХБП [2]. Оптимальная цель АД при лечении АГ в целом и при ХБП в частности остается предметом дискуссий и споров, несмотря на данные многочисленных клинических исследований [3]. К наиболее значимым рекомендациям по профилактике и лечению АГ при заболеваниях почек относят те, что исходят от Инициативы по улучшению глобальных исходов заболеваний почек – Kidney Disease Improving Global Outcomes (KDIGO) (2012) и Национального почечного фонда США – United States NKF KDOQI (2004) [2]. В клинических рекомендациях KDIGO-2012 верхний уровень рекомендуемого целевого АД < 140/90 мм рт. ст. при альбуминурии < 30 г/сут и до 130/80 мм рт. ст. при альбуминурии более 30 мг/сут [1]. Совсем недавно (2017 г.) руководство Американской коллегии кардиологов (American College of Cardiology, ACC) и Американской ассоциации кардиологов (American Heart Association, AHA) по АГ установило для пациентов с ХБП и лиц с повышенным сердечно-сосудистым риском целевое АД < 130/80 мм рт. ст. На эти рекомендации повлияло исследование SPRINT (Systolic Blood Pressure Intervention Trial) [25]. Согласно SPRINT в группе недиабетических пациентов с высоким сердечно-сосудистым риском, многие из которых имели ХБП, при интенсивной антигипертензивной терапии (целевой уровень АД < 120 мм рт. ст.) кардиоваскулярные события и летальность от любой другой причины была существенно ниже, чем в группе со стандартной терапией (целевой уровень АД < 140 мм рт. ст.). Однако при изучении влияния на почечные исходы наблюдалось существенное снижение СКФ, возрастала частота гипотензии, острого повреждения почек (ОПП) у лиц на интенсивной терапии без предшествующей ХБП [25, 26]. Таким образом, АД < 130/80 мм рт. ст. является научно обоснованным, целевым АД у пациентов с ХБП [25]. Сопоставимые результаты получили D. Ettehad и соавт. при метаанализе MEDLINE. Уменьшение систолического АД сопровождалось снижением риска ССЗ и смертности от всех причин. Однако в отношении почечной недостаточности эффект оказался не значимым. Следовательно, жесткий контроль АД в отношении кардиоваскулярных исходов оправдан, но как мера нефропротекции сомнителен. Независимо от этиологии ХБП и уровня протеинурии не рекомендуется добиваться снижения АД до уровня < 120/70 мм рт. ст. При использовании тактики жесткого контроля АД необходим тщательный контроль функции почек [27].
Принципы лечения АГ при ХБП
К актуальным вопросам ведения АГ относят: контроль циркадного ритма АД, целевые показатели АД, оценку вторичных форм, ограничение потребления соли, дозирование антигипертензивных препаратов [11]. Медикаментозная терапия пациентов с ассоциированной с ХБП АГ – трудная и сложная задача, поскольку причин для развития АГ значительно больше, чем у пациентов с АГ без ХБП. Кроме того, может потребоваться исключение псевдорезистентности и других вторичных причин [3]. Информации о тактике лечения резистентной АГ на фоне ХБП в современной литературе недостаточно. Имеющиеся данные касаются поэтапной оценки питания, образа жизни, приверженности к антигипертензивной терапии. Некоторые авторы отмечают необходимость исследования роли диуретиков и антагонистов минералокортикоидных рецепторов, а также современных методов лечения, таких как денервация почек и стимуляция барорецепторов [17]. Ключевым моментом в терапии АГ у пациентов с ХБП является использование комбинации антигипертензивных препаратов с оценкой СКФ [3]. К основным подходам лечения АГ при ХБП относят: ограничение поступления соли с пищей, лечение ингибиторами ангиотензинпревращающего фермента (иАПФ) или блокаторами рецепторов ангиотензина (БРА), диуретическую терапию [11, 12]. Перспективной является разработка клинических рекомендаций по дозированию антигипертензивных препаратов перед сном у пациентов с ХБП, что поможет восстановить ночные колебания АД. [11]. Воздействие на РААС является первоочередным компонентом нефропротективной терапии. Согласно последним рекомендациям в качестве препаратов первой линии у пациентов со СКФ выше 30 мл/мин/1,73 м2 следует использовать иАПФ [1, 24]. БРА тоже относят к препаратам первой линии, применяемым в случае непереносимости иАПФ [1, 3]. БРА как в качестве монотерапии, так и при комбинированной терапии оказывают благоприятное влияние на протеинурию, очевидна их потенциальная польза в лечении АГ и ХБП. Есть данные исследования о том, что существенных изменений расчетной СКФ во время терапии БРА не наблюдается [28]. иАПФ и БРА замедляют прогрессирование ХБП за счет снижения внутриклубочкового давления и темпов развития гломерулосклероза [25]. Одновременное использование двух блокаторов РААС не показано [14]. Для достижения целевого уровня АД наряду с иАПФ рекомендуется комбинированная терапия с использованием блокаторов кальциевых каналов (БКК) и диуретиков [24]. Недигидропиридиновые БКК уменьшают альбуминурию и замедляют снижение функции почек. Дигидропиридиновые БКК не рекомендуется применять в качестве монотерапии у пациентов с протеинурической ХБП, лучше в комбинации с блокаторами РААС. Диуретики широко используются при лечении пациентов с ХБП [1]. При СКФ < 30 мл/мин/1,73 м2 тиазидные диуретики заменяются петлевыми [14]. Все остальные группы препаратов следует назначать, когда лечение первичными не эффективно [1]. Снижение АД в начале лечения АГ при ХБП приводит к уменьшению почечного перфузионного давления до 10–20%. При этом необходим тщательный контроль электролитов крови и СКФ. Снижение СКФ обычно происходит в течение первых двух недель лечения и потом стабилизируется. Если снижение СКФ имеет более тяжелый характер, лечение рекомендуется прекратить и исключить реноваскулярную патологию [14]. К новым перспективным методам лечения АГ при ХБП относят применение рекомбинантной реналазы и ее аналогов для стимуляции деградации катехоламинов, а также пребиотиков и пробиотиков для нормализации микробиоты кишечника [23, 29].
Дополнительно в комплексную терапию больных ХБП следует включать немедикаментозные подходы к лечению АГ (модификация образа жизни, диетическое ограничение соли) [1, 3]. Устранение солевой чувствительности имеет решающее значение для управления АД, поскольку наиболее частой причиной АГ при ХБП является снижение способности почек выводить соль [11]. В последнее время уделяется внимание вопросу о роли физических упражнений при ХБП. Распространенность гиподинамии у пациентов с ХБП на 12–50% выше, чем в общей популяции. По данным когортного исследования этой проблемы у больных на гемодиализе доказано преимущество аэробных нагрузок в улучшении качества жизни и здоровья. Есть данные о том, что комбинированная аэробная нагрузка помогает уменьшить воспаление и инсулинорезистентность у пациентов с АГ на ранних стадиях ХБП [4].
Для больных с ТПН, получающих лечение гемодиализом, характерны колебания АД во время процедуры. Интрадиализная гипотензия и гипертензия — это особые ситуации, связанные с повышенным риском смертности. Пациенты с интрадиализной гипертензией имеют не совсем объяснимое увеличение сосудистого сопротивления во время диализа, и в качестве первоочередного метода лечения рекомендуется более агрессивное управление объемной перегрузкой [7, 10, 30].
Интрадиализная АГ регулярно встречается у 10–15% пациентов на гемодиализе. Пациенты с интрадиализной АГ обычно имеют небольшой междиализный прирост массы тела, но регулярное превышение внеклеточного объема по данным биоимпедансной спектроскопии. У пациентов с интрадиализной АГ наблюдается более низкий уровень альбумина и преддиализной мочевины, что может способствовать снижению осмолярности плазмы, препятствующей снижению АД. Также эндотелин-1 может являться медиатором интрадиализных скачков АД. Снижение целевой «сухой» массы тела, удаление избыточного натрия, снижение натрия в диализате могут препятствовать повышению и способствовать нормализации АД у более 60% пациентов [7, 30]. Антигипертензивные препараты этой категории больных следует назначать при стойко повышенном амбулаторном АД > 140/90 мм рт. ст. [30].
Литература/References
- Kalaitzidis R. G., Elisaf M. S. Treatment of Hypertension in Chronic Kidney Disease // Curr Hypertens Rep. 2018; 20 (8): 64. DOI: 10.1007/s11906-018-0864-0.
- Cai G., Chen X. Hypertension in patients with CKD in China: clinicalcharacteristics and management // Front. Med. 2017; 11 (3): 307–309. DOI: 10.1007/s11684-017-0578-8.
- Hamrahian S. M., Falkner B. Hypertension in Chronic Kidney Disease // Adv Exp Med Biol. 2017; 956: 307-325. DOI: 10.1007/5584_2016_84.
- Barcellos F. C., Del Vecchio F. B., Reges A., Mielke G., Santos I. S., Umpierre D. et al. Exercise in Patients With Hypertension and Chronic Kidney Disease: A Randomized Controlled Trial // J Hum Hypertens. 2018; 32 (6): 397–407. DOI: 10.1038/s41371-018-0055-0.
- Horowitz B., Miskulin D., Zager P. Epidemiology of Hypertension in CKD // Adv Chronic Kidney Dis. 2015; 22 (2): 88-95. DOI: 10.1053/j.ackd.2014.09.004.
- Зуева Т. В., Жданова Т. В., Уразлина С. Е. Коморбидность почечной и кардиальной патологии // Медицинский вестник Северного Кавказа. 2019; 14 (4): 711–717. // Meditsinsky vestnik Severnogo Kavkaza. 2019; 14 (4): 711–717 (In Russ)]. DOI: https://doi.org/10.14300/mnnc.2019.14178.]
- Peco-Antic A., Paripovic D. Renal Hypertension and Cardiovascular Disorder in Children With Chronic Kidney Disease // Srp Arh Celok Lek. 2014; 142 (1–2): 113–117. DOI: 10.2298/sarh1402113p.
- Valika A., Peixoto A.J. Hypertension Management in Transition: From CKD to ESRD // Adv Chronic Kidney Dis. 2016; 23 (4): 255–61. DOI: 10.1053/j.ackd.2016.02.002.
- Agarwal R., Flynn J., Pogue V., Rahman M., Reisin E., Weir M.R. Assessment and management of hypertension in patients on dialysis // J Am Soc Nephrol. 2014; 25: 1630–646. DOI: 10.1681/ASN.2013060601.
- Van Buren P. N., Inrig J. K. Special Situations: Intradialytic Hypertension/Chronic Hypertension and Intradialytic Hypotension // Semin Dial. 2017; 30 (6): 545–552. DOI: 10.1111/sdi.12631.
- Judd E., Calhoun D. A. Management of Hypertension in CKD: Beyond the Guidelines // Adv Chronic Kidney Dis. 2015; 22 (2): 116–122. DOI: 10.1053/j.ackd.2014.12.001.
- Ku E., Lee B. J., Wei J., Weir M. R. Hypertension in CKD: Core Curriculum 2020 // Am J Kidney Dis. 2019; 74 (1): 120–131. DOI: 10.1053/j.ajkd.2018.12.044.
- Babu M., Drawz P. Masked Hypertension in CKD: Increased Prevalence and Risk for Cardiovascular and Renal Events // Curr Cardiol Rep. 2019; 21 (7): 58. DOI: 10.1007/s11886-019-1154-4.
- Williams B., Mancia G., Spiering W., Agabiti Rosei E., Azizi M., Burnier M., et al. 2020 ESC/ESH Guidelines for the management of arterial hypertension // Eur Heart J. 2018; 39: 3021-3104. DOI: 10.1093/eurheartj/ehy339.
- Carey R. M., Calhoun D. A., Bakris G. L., Brook R. D., Daugherty S. L., Dennison-Himmelfarb C. R., et al. Resistant Hypertension: Detection, Evaluation, and Management: A Scientific Statement From the American Heart Association // Hypertension. 2018; 72 (5): 53–90. DOI: 10.1161/HYP.0000000000000084.
- Whelton P. K., Carey R. M., Aronow W. S., Casey D. E. Jr., Collins K. J., Dennison Himmelfarb C., et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines // Hypertension. 2018; 71 (6): 13–115. DOI: 10.1161/HYP.0000000000000065.
- Braam B., Taler S. J., Rahman M., Fillaus J. A., Greco B. A., Forman J. P., Reisin E. et al. Recognition and Management of Resistant Hypertension // Clin J Am Soc Nephrol. 2017; 12 (3): 524–535. DOI: 10.2215/CJN.06180616.
- Schmid H., Schiffl H., Lederer S. R. Erythropoiesis-stimulating Agents, Hypertension and Left Ventricular Hypertrophy in the Chronic Kidney Disease Patient // Curr Opin Nephrol Hypertens. 2011; 20 (5): 465–470. DOI: 10.1097/MNH.0b013e3283497057.
- Qian Q. Salt. Water and Nephron: Mechanisms of Action and Link to Hypertension and Chronic Kidney Disease // Nephrology (Carlton). 2018; 23 (Suppl 4): 44–49. DOI: 10.1111/nep.13465.
- Boyle S. M., Berns J. S. Erythropoietin and Resistant Hypertension in CKD // Semin Nephrol. 2014; 34 (5): 540–549. DOI: 10.1016/j.semnephrol.2014.08.008.
- Nongnuch A., Campbell N., Stern E., El-Kateb S., Fuentes L., Davenport A. et al. Increased postdialysis systolic blood pressure is associated with extracellular overhydration in hemodialysis outpatients // Kidney Int. 2015; 87: 452–457. DOI: 10.1038/ki.2014.276.
- Sharaf E. I. Din UAA, Salem M. M., Abdulazim D. O. Uric Acid in the Pathogenesis of Metabolic, Renal, and Cardiovascular Diseases: A Review // J Adv Res. 2017; 8 (5): 537–548. DOI: 10.1016/j.jare.2016.11.004.
- Felizardo R. J. F., Watanabe I. K. M., Dardi P., Rossoni L. V., Camara N. O. S. The Interplay Among Gut Microbiota, Hypertension and Kidney Diseases: The Role of Short-Chain Fatty Acids // Pharmacol Res. 2019; 141: 366–377. DOI: 10.1016/j.phrs.2019.01.019.
- Huang Q. F., Hoshide S., Cheng H. M., Park S., Park C. G., Chen C. H. et al. Characteristics On the Management of Hypertension in Asia-Morning Hypertension Discussion Group (COME Asia MHDG) Management of Hypertension in Patients With Chronic Kidney Disease in Asia // Curr Hypertens Rev. 2016; 12 (3): 181–185. DOI: 10.2174/1573402113666161122114854.
- Chang A. R., Lóser M., Malhotra R., Appel L. J. Blood Pressure Goals in Patients With CKD: A Review of Evidence and Guidelines // Clin J Am Soc Nephrol. 2019; 14 (1): 161–169. DOI: 10.2215/CJN.07440618.
- The SPRINT Research Group. A randomized trial of intensive versus standard blood-pressure control // Vnitr Lek. 2016; 62 (1): 44–47.
- Ettehad D., Emdin C. A., Kiran A., Anderson S. G., Callender T., Emberson J. et al. Blood pres-sure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis // The Lancet. 2016; 387 (5): 957–967.
- Burnier M., Lin S., Ruilope L., Bader G., Durg S., Brunel P. Effect of Angiotensin Receptor Blockers on Blood Pressure and Renal Function in Patients With Concomitant Hypertension and Chronic Kidney Disease: A Systematic Review and Meta-Analysis // Blood Press. 2019; 28 (6): 358–374. DOI: 10.1080/08037051.2019.1644155.
- Ficek J., Malyszko J., Chudek J. Renalase and its role in the development of hypertension in patients with chronic renal failure // Przegl Lek. 2015; 72 (6): 306–308.
- Van Buren P. N. Pathophysiology and Implications of Intradialytic Hypertension // Curr Opin Nephrol Hypertens. 2017; 26 (4): 303-310.
Т. В. Зуева1, кандидат медицинских наук Т. В. Жданова, доктор медицинских наук, профессор
ФГБОУ ВО УГМУ, Екатеринбург, Россия
1 Контактная информация
DOI: 10.26295/OS.2020.19.20.002
Артериальная гипертензия при хронической болезни почек: современное состояние проблемы/ Т. В. Зуева, Т. В. Жданова Для цитирования: Лечащий врач № 9/2020; Номера страниц в выпуске: 11-14 Теги: сердечно-сосудистые заболевания, почки, обмен натрия, риск
Купить номер с этой статьей в pdf
Возможные осложнения
Пренебрежение рекомендациями врача или неадекватная терапевтическая стратегия зачастую становятся виновниками развития трудно поддающихся лечению заболеваний, не говоря уже про возможный летальный исход. Высокий показатель артериального давления при поражении почек многократно повышает риск возникновения следующих расстройств:
- нарушение биохимического состава крови;
- ухудшение мозгового кровообращения;
- геморрагический инсульт головного мозга;
- отек легочной ткани;
- прогрессирование почечной или сердечной недостаточности;
- слепота, возникающая в результате поражения зрительного нерва и кровоизлияния в сетчатку;
- ишемическая болезнь сердца;
- некроз паренхимных тканей.
Синдром почечной эклампсии
Эклампсис –
вспышка, судороги. Именно судороги манифестируют при синдроме почечной эклампсии.
острый диффузный гломерулонефрит
В патогенезе основное значение отводится увеличению внутричерепного давления, церебральному ангиоспазму и отеку мозговой ткани.
В развитии данных состояний не последнюю роль играют гемодинамические нарушения, связанные со снижением ОЦК, среди гемодинамических нарушений стоит выделить изменение реологических свойств крови с нарушением микроциркуляции. К уменьшению ОЦК приводит нарушение водно–электролитного баланса, увеличение гидрофильности ткани и уменьшения онкотического давления плазмы крови.
Выделяют 3 стадии эклампсии.
Первая стадия:
период мелких фибриллярных сокращений лица и верхних конечностей (30 с – 1,5 мин), сознание сохранено;
2) Вторая стадия:
период тонических судорог. Сокращается вся скелетная мускулатура. Происходит задержка дыхания, вплоть до его полной остановки. Лицо бывает резким цианотичным, местные вены расширены, может отсутствовать сознание (20 – 25 с); АД повышено, пульс напряженный.
Третья стадия:
период клонических судорог мышц туловища, верхних и нижних конечностей, происходит восстановление дыхания, изо рта вытекает пена, зрачки расширены и на свет не реагируют, пульс редкий. Весь приступ длится 2,5 – 3,5 минуты. После приступа больной некоторое время находится в состоянии оглушенности, глубокого сопора. Иногда сохраняется афазия (расстройство речи), амавроз (слепота центрального происхождения).
Меры профилактики
Чтобы не допустить возникновения почечной гипертензии, важно на регулярной основе придерживаться простых, но действенных профилактических мер. Для этого нужно:
- не забывать измерять артериальное давление;
- при тревожных симптомах обращаться за квалифицированной помощью;
- не злоупотреблять солеными блюдами;
- следить за массой тела;
- отказаться от сигарет и спиртных напитков;
- не переохлаждаться;
- всячески укреплять иммунитет;
- вести активный образ жизни.
Причины заболевания
В основе формирования почечного повышенного давления всегда лежит поражение сосудов почек. Часто это происходит по различным причинам. Например, в ходе аутоиммунных заболеваний, возникших в результате стафилококковых или стрептококковых инфекций, антитела иммунной системы начинают атаковать не антигены, а ткани организма, в частности, ткани почек. Такое заболевание носит название «гломерулонефрит». Если поражаются не только ткани почек, но и другие ткани организма, то имеет место системное аутоиммунной заболевание, например, системная красная волчанка, васкулит, синдром Шегрена.
Также поражение почечной артерии может происходить по механическим причинам, например, из-за наличия конкремента в почках. В этом случае артерия либо непосредственно поражается, либо вызывает закупорку мочеточника и гидронефроз, который повреждает ткани почек, в том числе и сосуды.
Реже в качестве причины выступает тромбоз или тромбоэмболия почечной артерии, поражение сосудов в зоне устьев (местах их разветвлений), генетическая аномалия строения органов мочевыделительной системы.
Диагностика
Для того чтобы поставить диагноз «реноваскулярная или почечная гипертония», необходимо обследовать как сосудистую, так и мочевыделительную систему. При осмотре пациента врач замечает признаки, которые говорят о неполадках со стороны почек.
Для обследования сердечно-сосудистой системы производится мониторинг артериального давления, который делается путем замера показателей не менее двух раз в сутки или с помощью специального аппарата на протяжении 24 часов. Вместе с этим проводится электрокардиограмма, УЗИ сердца, УЗДГ сосудов. Это необходимо и для выявления причин патологии, и для того, чтобы оценить степень ущерба, который нанесла гипертония.
Диагностика мочевыделительной системы включает в себя лабораторные анализы и функциональные пробы:
- полный анализ мочи;
- клинический анализ крови на уровень натрия, мочевой кислоты, калия, мочевины, креатинина;
- проба Реберга;
- проба Зимницкого;
- УЗИ почек;
- ренография почек;
- МРТ или КТ мочевыделительной системы.
При гипертонии на фоне повышенного ренина наиболее точным анализом является забор крови на исследование концентрации ренина непосредственно из почечной артерии. Но такая процедура весьма травматична, поэтому в большинстве случаев врачи не прибегают к катетеризации почечной артерии, а ставят диагноз на основании совокупности исследований и дифференциальном анализе.