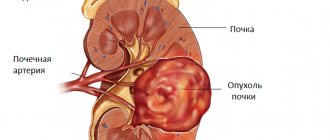
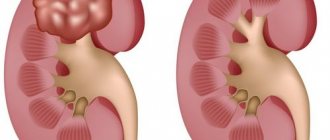
В развитии современной онкологии огромную роль играет молекулярная генетика. Существуют анализы, которые помогают обнаружить вещества, необходимые раковым клеткам для выживания, быстрого размножения, «маскировки» от иммунной системы. Знания об этих веществах помогли создать препараты, которые могут их заблокировать, тем самым остановив рост опухоли. Такие препараты называют таргетными, от английского слова target — «цель», «мишень». В отличие от химиопрепаратов, они действуют прицельно на раковые клетки.
В настоящее время таргетная терапия бурно развивается. Многие новые препараты проходят клинические испытания, многие уже применяются для лечения пациентов. Некоторые можно использовать при раке почки.
Описание
Таргетная (целевая) терапия – это тактика лечения, при которой уничтожаются больные клетки, не нанося ущерб здоровым. Традиционная химиотерапия переносится пациентами тяжело и болезненно. Целевые лекарства улучшают здоровье больного, значительно продлевая годы жизни. Врач прописывает препараты на 3-4 стадии заболевания.
Принцип работы
С английского языка таргетный переводится как мишень. Поэтому второе название таргетной терапии – целевая. Препараты прицельно воздействуют на злокачественные клетки, не допуская получения необходимых веществ. В итоге их существование и размножение прерывается. Иммунный системный блок начинает отличать здоровые клетки от больных. Происходит уничтожение злокачественного клеточного состава.
Показания к применению
Лечебный процесс рака почки состоит из нескольких методов: химиотерапия, хирургическое удаление образования, облучение и целевая терапия. При выборе метода врач берет во внимание индивидуальные особенности больного и прогрессирование конкретной разновидности опухоли. Таргетное лечение прописывается пациенту, если диагностируется:
- неоперабельная первичная опухоль;
- метастатический рак почки;
- запрет на проведение операции или других методов лечения;
- рецидив.
Во время лечения применяются один или несколько наименований медикамента. План терапии сугубо индивидуален для каждого больного. Чтобы определить оптимальный вариант, используется системный блок стратификации риска комплексно с генетическим тестом.
В каких случаях при раке почек назначают таргетную терапию?
Основное показание к назначению таргетных препаратов при злокачественных опухолях почек — неэффективность химиотерапии. Таргетная терапия часто применяется при запущенных злокачественных опухолях на поздних стадиях. Она не предназначена для того, чтобы вылечить рак, но может уменьшить размеры опухоли, замедлить ее рост — это помогает увеличить продолжительность жизни пациента.
Другая сфера применения таргетных препаратов при раке почки — в качестве адъювантной терапии после хирургического лечения. Препарат под названием сунитиниб помогает предотвратить рецидив.
Таргетные препараты при раке почки назначают, как правило, в режиме монотерапии. Одни из них нужно принимать в таблетках, другие вводят внутривенно. Если препарат не работает, его отменяют и назначают другой.
Таргетная терапия при злокачественных опухолях почек пока изучена недостаточно, нельзя сказать, какое лекарство будет работать лучше всего в данном случае, стоит ли их комбинировать, чтобы усилить эффект, и если стоит, то как это правильно делать. Эти нюансы еще предстоит выяснить в ходе исследований.
Написать врачу-онкологу
Препараты первой линии
Представленный вид медикаментов применяется для уменьшения или контролирования течения заболевания при распространенных опухолевых образованиях. Итоги исследования и отклики пациентов свидетельствуют об эффективности таргетной терапии.
Замедляется развитие раковых клеток на несколько месяцев, а иногда лет.
Систематический прием лекарств контролирует протекание болезни. На протяжении всего терапевтического процесса пациент посещает врача, каждые 2-3 недели.
Один раз в 90 дней специалист назначает сканирование. По результатам определяется эффективность лечения.
Сунитиниб
Препарат прописывается при вторичных очагах, на 3–4 этапе патологии. Относится к группе ингибиторов. Выступает блокиратором внутриклеточных белков (тирозинкиназов) в опухолевых клетках, прекращает их разрастание и деление. Состав медикамента препятствует кровоснабжению, клетки обделены питательными элементами и кислородным составом.
К нежелательным осложнениям приема Сунитиниба можно отнести: утомление, анемию, модификацию вкусовых качеств, высыпания. Возможно нарушение функционирования щитовидной железы. Поэтому назначается систематический анализ крови.
Пазопаниб
Препарат назначается как при первичной терапии развивающегося опухолевого процесса, так и вторичной после использования интерферона. Считается распространенным ингибитором роста рака. Выпускается в форме таблеток, прием – ежедневный.
Последствия: рвота, зуд, сыпь, диарея.
Препараты оказывают целенаправленное воздействие на онко клетки. Преимущество: сохранение здоровых клеток, легкая переносимость (если сравнивать с химиотерапией).
Таргетное лечение ингибиторами антиогенеза
Для полноценного роста новообразования в нем должны развиваться новые сосуды, по ним к тканям раковых клеток будет поступать кислород и питательные вещества. Клетки опухоли способны производить множество факторов роста, которые будут стимулировать появление новых сосудов. Этот процесс называется антиогенезом, а влияние ингибиторами антиогенеза заметно замедляет злокачественный процесс.
Это важно! Механизмы влияния таргетных медикаментов отличаются от влияния химиотерапевтических средств, так как первые нарушают разрастание опухоли на уровне молекул и минимально влияют на здоровую ткань.
Препараты второй линии
Если препараты первой группы не справились с заболеванием и раковые клетки вновь начинают разрастаться назначаются препараты второй линии.
Авастин
Медикамент выступает моноклинальным антителом, замедляет развитие кровеносных сосудов в опухолевых образованиях. Средство принимается комплексно с интерфероном. Авастин – каждые 14 дней, интерферон – 3 раза в 7 дней.
Прием препарата сопровождается гриппоподобными симптомами. Чтобы избежать простудных проявлений, за 30 минут до инъекции употребляется парацетамол. К иным последствиям относится: меланхолия, тошнота и развитие гипертонии.
Темсиролимус
Назначается внутривенно, 1 раз в семь суток. Относится к средствам МТОР ингибиторов, препятствует росту злокачественных клеточных структур. Назначается при распространенных опухолевых процессах.
Нежелательные симптоматические проявления: покраснения и высыпания на коже, воспалительные течения ротовой полости.
Несмотря на эффективность лекарственных средств, все они имеют побочные явления. Перед назначением целевой терапии врач консультирует пациента, объясняет, как легче преодолеть последствия.
Кабозантиниб
Механизм действия. Блокирует ферменты-тирозинкиназы, в том числе те, которые нужны для формирования в опухолевой ткани новых сосудов. Препарат второй линии, применяется, когда не помогло другое лечение. Кабозантиниб принимают в таблетках один раз в день.
Побочные эффекты:
- Тошнота и рвота.
- Жидкий стул.
- Повышенная утомляемость.
- Повышенное артериальное давление.
- Плохой аппетит и снижение веса.
- Запоры.
- Синдром «кисть-стопа».
- Редко встречаются более серьезные побочные эффекты: сильные кровотечения, тромбы, тяжелая диарея, повреждение стенки кишечника.
Противопоказания
Целевая терапия рака почек ─ новая разработка в борьбе со злокачественными опухолями. Она тормозит формирование РП на молекулярном уровне.
По теме
- Лечение
Как лечить цистит после химиотерапии
- Наталья Геннадьевна Буцык
- 4 декабря 2020 г.
Представленные препараты эффективны и действенны, но все же имеют ряд противопоказаний.
Сунитиниб и Пазопаниб противопоказан:
- в период беременности и грудного вскармливания;
- при повышенной восприимчивости к лекарственным компонентам;
- детям;
- людям с сердечными заболеваниями;
- при нарушении электролитного баланса.
Требуется осторожность и уменьшение дозировки при комплексном приеме Сунитиниба и сильнейших ингибиторов CYP3A4.
Противопоказания Авастина:
- метастазы ЦНС;
- печеночная недостаточность;
- беременность и лактация;
- детям (до 18 лет);
С особой осторожностью препарат назначается при гипертензии (артериальной), людям возрастом старше 65 лет.
Темсиролимус практически не имеет противопоказаний. Не рекомендуется принимать:
- детям и подросткам (до 18 лет);
- беременным женщинам;
- во время лактации;
- при повышенной чувствительности к темсиролимусу и его метаболитам.
Таргетное лечение прописывается врачом после тщательного обследования, всего организма.
Лечение гормонорезистентного рака предстательной железы (ГР- РПЖ) является важной проблемой современной онкоурологии. При метастатическом характере опухоли на фоне гормональной терапии возникает улучшение в виде уменьшения болей, снижения уровня ПСА, частичной регрессии метастазов, однако рано или поздно развивается гормонорезистентность опухоли. Время между началом приема гормональных препаратов и развитием гормонорезистентности составляет около 12-18 мес., что объясняется ростом клона андрогенне- зависимых клеток на фоне вторичной гормонорезистентности [1, 2]. Необходимо добавить, что у 15-20% больных опухоль первично резистентна к гормональной терапии.
Диагноз гормонорезистентного рака ставится при наличии роста уровня свободного ПСА крови либо других признаков прогрессирования заболевания при адекватной андрогенной блокаде с подтвержденным достоверным кастрацион- ным уровнем тестостерона [3].
Результаты лечения ГР-РПЖ являются неудовлетворительными. Предложены различные схемы хи-миотерапии (ХТ) (таблица 1).
В качестве химиотерапии были предложены различные схемы с использованием цитотоксических препаратов: митоксантрон + пред- низолон [13], эстрамустин [14, 15], эстрамустин+ винбластин или + ви- норельбин [15, 17]
Однако в крупных рандомизиро-ванных исследованиях SWOG 9916 и TAX было установлено, что медиана продолжительности жизни, частота снижения ПСА и частота паллиативного ответа с улучшением качества жизни были статистически выше в группах доцетаксела. С этого момента и по настоящее время схема доцетаксел + преднизолон является стандартом в лечении гормонорезистентного рака простаты [18].
Общая выживаемость при использовании цитотоксичных препаратов составляет от 6,9 до 19 мес., что требовало дальнейших научных разработок.
Для улучшения показателей выживаемости были предприняты попытки пересмотра принципов лекарственной терапии. Для преодоления резистентности к химиопрепаратам предлагалось воздействовать на процессы проли-ферации и дифференцировки в опу-холевых клетках (ингибиторы тиро- зинкиназ, dose-dense-терапия), на микроокружение опухоли (ингибиторы ангиогенеза; метрономная терапия; препараты, воздействующие на строму опухоли) либо оказывать комбинированное воздействие на опухоль и ее окружение (ChemoSwitch-режим).
Таблица 1. Эффективность химиотерапии гормонорезистентного рака простаты
| Исследование | Тип исследования | Число пациентов | Препарат | Частичный ответ (5): снижение ПСА > 50% | Время до прогрессии (мес.) | Общая выживаемость (мес.) |
| Loriot et al., 2009 [4] | Проспективное | 40 | Carboplatin/etoposide | 23 | 2,1 | 19,0 |
| Rosenberg et al., 2007 [5] | Проспективное | 41 | Mitoxantrone | 20 | 2,3 | 9,8 |
| Rosenberg et al., 2007 [5] | Проспективное | 41 | Ixabepilone | 17 | 2,2 | 10,4 |
| Ross et al., 2008 [6] | Проспективное | 34 | Docetaxel/carboplatine | 18 | 3 | 12,4 |
| Sternberg et al.,2007 [7] | Проспективное | 327 | Satraplatine | 2,5 | ||
| Eymard et al.,2007 [7] | Ретроспективное | 31 | Docetaxel | 59 | н/д | н/д |
| Berthold et al., 2008 [9] | Ретроспективное | 89 | Mitoxantrone | 10 | 3,2 | 10 |
| Nakabayashi et al., 2007 [10] | Ретроспективное | 36 | Vinorelbine | 14 | 6,9 | |
| Nakabayashi et al., 2007 [10] | Ретроспективное | 35 | Mitoxantrone | 12 | 2-3 | 12 |
| Oh et al., 2006 [12] | Ретроспективное | 35 | Mitoxantrone | 6 | 1,5 |
Таблица 2. Таргетные препараты в лечении гормонорезистентного рака простаты [22]
| Точка приложения | Биологический эффект | Препарат | Стадия клинического внедрения |
| 17a hydroxylase/C17, 20 lyase | Suppression of adrenal androgen precursors | Abiraterone acetate | Phase I/II |
| HSP90 | Inhibition of AR signalling | 17-AAG, 17-DMAG | Phase II, Phase I |
| HDAC | Downregulation of AR | SAHA, FK228 | Phase II, Phase II |
| Vitamin D receptor | Agonism of VDR antiproliferative effects | DN-101, EB1089 | Phase III, Phase I |
| PI3 kinase | Inhibit PI3K signalling axis | P1-103, ZSTK474 | Phase I |
| mTOR | Inhibition of mTOR-dependent protein translation | CCI-779, RAD001 | hase II, Phase II |
| IGF1-R | Inhibit IGF1-R signalling axis | CP-751, 8 | Phase II |
| ErbB receptor family | Inhibit erbB signalling axis | Gefitinib, Pertuzumab (2C4) | Negative phase II trials, Negative phase II trials |
| Survivin | Proapoptotic | YM-155 | Phase II |
| BCl-2 | Proapoptotic | G3139 | Phase II |
| VEGF | Antiangiogenesis | Bevacizumab, Sunitinib, Sorafenib | Phase III, Phase II, Phase II |
| VEGFR | Antiangiogenesis | BAY 43-9006, AZD2171 | Phase II, Phase I/II |
| ETA | Inhibition of endothelin-1 axis | Atrasentan | Phase III trials |
| b-Tubulin | Cell-cycle arrest | Ixabepilone, E7389 | Phase II/Phase III |
Применительно к ГР-РПЖ одним из направлений было изучение метрономной терапии. Суть ее за ключается в длительном, ежедневном применении сравнительно не-больших доз химиопрепаратов, за счет чего достигается антиангиоген- ный, а не цитотоксический эффект препарата [19]. Lord R. проводил 80 больным химиотерапию циклофос- фамидом 50 мг внутрь ежедневно. Объективный ответ отмечался у 34,5%, время до прогрессирования составило 7,5 мес. [20].
Новые надежды на улучшение результатов лечения ГР-РПЖ связываются с применением таргетной терапии [21]. В настоящее время предложены следующие препараты для лечения ГР-РПЖ (таблица 2).
Одним из направлений исследований по применению таргетных препаратов при лечении ГР-РПЖ являлась комбинация их с цито- токсичными препаратами. Было доказано, что потенцирование бе- вацизумабом эффективности химиотерапевтической схемы IFL при метастатическом колоректальном раке. Применительно к ГР-РПЖ в настоящее время в эксперименте также проверяются комбинации с доцетакселом. Доцетаксел оказывает противоопухолевое действие, стабилизируя микротрубочки, угнетает их распад, снижает концентрацию свободного тубулина, что приводит в конечном итоге к нарушению фазы митоза и меж- фазных процессов. Применение моноклональных антител к VEGF (сосудистому эндотелиальному фактору роста) бевацизумаб увели-чивает антипролиферативное действие доцетаксела в эксперименте на клеточной линии рака простаты и молочной железы. Потенцирование достигается благодаря снижению васкуляризации опухоли.
Описанный эффект открывает до-полнительные возможности для клинических исследований как для бевацизумаба, так других таргет- ных препаратов, основанных на ингибировании ангиогенеза (суни- тиниб, сорафениб, гефитиниб) [23]. Потенциальную эффективность противоопухолевой терапии показали исследования эффекта ингибирования имидазола (1,2-а) пиразин диарилуреазой рецептора тирозин- киназы [24].
Таблица 3. Характеристика групп больных и результаты в исследовании Dror Michaelson M., 2009 [35]
| Группы больных | Группа больных без предшествующей ХТ | Группа больных, резистентных к доцетакселу |
| Число больных | 17 | 17 |
| Возраст (медиана, разброс) | 71 (52-80) | 65 (45-84) |
| Уровень ПСА (нг/мл) (медиана, разброс) | 51 (7-602) | 44 (8-752) |
| Наличие костных метастазов | 12 | 15 |
| Только повышение ПСА | 1 | 0 |
| Предшествующее лечение | ||
| Гормонотерапия (1-3 курса) | 11 | 12 |
| Гормонотерапия (4-6 курсов) | 6 | 4 |
| Химиотерапия (медиана, разброс) | 0 | 8 (3-14) |
| Эффективность лечения | ||
| Эффективность лечения Динамика уровня ПСА | ||
| Ответ: снижение уровня на ? 50% | 1 | 1 |
| Стабилизация: нет признаков ответа или прогрессирования | 8 | 7 |
| Прогрессирование: увеличение на ? 25% | 7 | 7 |
| Результат невозможно оценить | 1 | 2 |
| Оценка эффекта, основанная на радиологических данных | ||
| Частичный ответ | 0 | 1 |
| Стабилизация | 10 | 8 |
| Прогрессия | 5 | 5 |
| Результат невозможно оценить | 1 | 3 |
| Эффект, неприемлемый для оценки | 1 | 0 |
Влияние ангиогенеза, доказанное в преклинических и клинических исследованиях, на развитие РПЖ позволило рассматривать ингибиторы ангиогенеза (например, сунитиниб) в качестве перспективного направления в лечении ГР- РПЖ [25, 26, 27]. У мужчин, больных РПЖ, отмечается повышение VEGF (сосудистого эндотелиального фактора роста), при этом отмечается ассоциация его высокого уровня в плазме с большей смертностью [20, 28, 30].
Сунитиниб является хорошо за-рекомендовавшим себя таргетным препаратом, наиболее изученным у больных генерализованным раком почки. Препарат представляет собой ингибитор рецептора киназы VEGF 1, 2 и 3 типа тромбоцитарно- го ростового фактора PDGF а- и в-, Kit and RET [31, 32]. Интересно, что данный препарат показал свою эффективность при лечении пациента с метастазом рака почки в предстательную железу через 10 лет после радикальной нефрэктомии [33].
Cumashi A. и соавторы в 2008 г. проводили лабораторным животным, которым прививались клетки человеческого ГР-РПЖ, химиотерапию сунитинибом в монорежиме в комбинации с низкодозной и высо- кодозной химиотерапией доцетак- селом. Авторами сделаны выводы о перспективности применения суни- тиниба в комбинации с низкодозной ХТ доцетакселом либо в монорежиме в клинической практике [34].
Представляется наиболее акту-альным вопрос о проведении химио-терапии сунитинибом в качестве второй линии химиотерапии после доцетаксела.
Dror Michaelson M. и соавторы в 2009 г. провели исследование в рамках II фазы исследования [35]. В работу было включено 34 больных ГР-РПЖ, из них 17 больных, не получавших химиотерапию, и 17 больных, перенесших в среднем 8 (3-14) курсов химиотерапии доцетакселом без эффекта (таблица 3).
Больным проводилось ХТ по схеме: 50 мг/день в течение 4 недель с последующим двухнедельным перерывом. При развитии осложнений уровень редукции составлял 37,5или 25 мг. Стабилизация уровня ПСА отмечалось у 8 и 7 больных соответственно; повышение уровня ПСА — у 7 и 7 больных соответственно. Стабилизация процесса наблюдалась у 10 больных первой группы и у 8 — второй. Прогрессирование было у 5 пациентов в обеих группах. Действие сунитиниба было подтверждено маркерами ангиогенеза. С другой стороны, авторы отмечают периодическое расхождение показателей рентгенологических исследований и уровня ПСА. На основании этого были сделаны выводы о необходимости альтернативных методов оценки эффективности лечения, дополнительно к ПСА [35].
Sonpavde G. и соавторы в 2009 г. доложили результаты лечения 36 больных (медиана возраста 69,5 лет) в рамках II фазы исследования препарата у больных после предшествующей неэффективной химиотерапии доцетакселом. Больным перорально давалось 50 мг/день препарата в течение 4 недель с последующим двухнедельным перерывом. Параллельно проводилась гормональная терапия — до 8 курсов. Критерием исключения было наличие признаков прогрессирования или выраженные токсические эффекты. Проводилась оценка среднего времени без прогрессии.
Среднее время без прогрессии составило 19,4 недель, причем от-сутствие прогрессии в течение 12 недель отмечалась у 75,8% больных. У 52,8% больных вследствие токсических эффектов потребовалось провести перерыв в химиотерапии [36].
Есть сведения о планирующихся и проводящихся в настоящее время клинических исследованиях пазо- паниба при раке предстательной железы.
В настоящее время в США проводится набор пациентов в исследование фазы II пациентов с метастатическим раком предстательной железы, устойчивым к полной андрогенной блокаде. Пациенты, которые будут включаться в иссле-дование, ранее получали терапию агонистами рилизинг-фактора лю- теинезирующего гормона. Пазопа- ниб будет назначаться в дозировке 800 мг в день в течение 12 недель [37].
В США проводится рандомизированное исследование фазы II, в котором оценивается эффективность пазопаниба в лечении рецидивирующего рака предстательной железы у пациентов, ранее получавших гозелерин или лейпролид. В исследование включено 98 пациентов, они рандомизированы в две группы, в одной из которых они получают пазопаниб, а в другой — только активное наблюдение. Завершение исследования планируется в декабре 2011 г. [38].
| Рисунок 1. Алгоритм лечения больных ГР-РПЖ (22) |
В настоящее время проводится набор в исследование фазы I/II, в котором будет оцениваться эффективность и безопасность доцетак- села/преднизолона в комбинации с пазопанибом у пациентов с метастатическим раком предстательной железы. Завершение исследования планируется в декабре 2014 г. [39].
На основании представленных данных, алгоритм лечения ГР-РПЖ и место в нем таргетной терапии в современной онкоурологии можно представить следующим образом (рисунок 1).
В случае, если больной получал монотерапию аналогами ЛГРГ, не-обходимо добавить антиандрогены. При дальнейшем повышении ПСА необходимо оценить распространенность опухоли лучевыми методами. При изолированном повышении ПСА целесообразно назначить препараты второй линии — кетоконазол, бикалутамид в высокой дозе, эстрогены (при отсутствии выраженной сердечно-сосудистой патологии) или эстрамустин в монотерапии. При обширном метаста-тическом поражении или при быстром удвоении ПСА (менее чем за 2 месяца), необходимо сразу начинать химиотерапию. Стандартной схемой является доцетаксел 75 мг/м2 каждые 3 недели в сочетании с пред- низолоном. В среднем проводится 6-8 курсов химиотерапии при приемлемой токсичности. При возникновении прогрессирования около 25% пациентов, как правило, вновь могут получить эффект от повторных курсов химиотерапии. При отсутствии эффекта пациенты в большинстве случаев переводятся в группу симптоматической терапии. Использование альтернативных вариантов химиотерапии, возможно, позволит увеличить продол-жительность и улучшить качество жизни этих пациентов.
Основываясь на проанализиро-ванных литературных данных, можно сделать следующие выводы.
Применение таргетной терапии является одним из перспективных направлений в лечении ГР-РПЖ.
Включение в схему ХТ таргет- ных препаратов, возможно, позволит повысить эффективность традиционных схем ХТ, прежде всего доцетаксела. Обоснование данных схем лечения находится на экспериментальном этапе.
Применение таргетной терапии сунитинибом в качестве второй линии лечения после неэффективной терапии доцетакселом является оправданным.
Ключевые слова: гормонорезистентный рак предстательной железы, таргентная терапия, препараты, алгоритм лечения.
Keywords: hormone-refractory prostate cancer, targeting therapy, drugs, treatment alhoritm.
ЛИТЕРАТУРА
- Yagoda A., Petrilak D. Cytotoxic chemotherapy for advanced hormone resistana prostate cancer // Cancer. 1993. Vol. 71. P. 1098-1109.
- Abrahamsson P.A. Intermittent androgen blockade. Too good to be true? //Scand J Urol Nephrol Suppl. 1999. Vol. 203. P. 45-49.
- Small E.J., Vogelzang N.J. Second-line hormone therapy for advanced prostate cancer: a shifting paradigm // J Clin Oncol. 1997. Vol. 15. P. 382-388.
- Loriot Y., Massard C., Gross-Goupil M., Di Palma M., Escudier B., Bossi A., Fizazi K. Combining carboplatin and etoposide in docetaxelpretreated patients with castration-resistant prostate cancer: a prospective study evaluating also neuroendocrine features // Annals of Oncology. 2009. Vol. 20. P. 703-708.
- Rosenberg J.E., Weinberg V., Kelly W.K., Michaelson D., Hussain M.H., Wilding G., Gross M., Hutcheon D., Small E.J. Activity of second-line chemotherapy in docetaxel- refractory hormone-refractory prostate cancer patients: randomized phase 2 study of ixabepilone or mitoxantrone and prednisone // Cancer. 2007. Vol. 110. № 3. P. 556563.
- Ross R.W., Beer T.M., Jacobus S., Bubley G.J., Taplin M.E , Ryan C.W., Huang J., Oh W.K.; Prostate Cancer Clinical Trials Consortium. A phase II trial of carboplatin plus docetaxel in hormone-refractory prostate cancer patients who have refractory after docetaxel chemotherapy.// Cancer. 2008. Vol. 112. № 3. P. 521-526.
- Sternberg C.N., Petrylak D., Witjes F., Ferrero J., Eymard J., Falcon S., Chatta K., Vaughn D., Berry W., Sartor O. Satraplatin demonstrates significant clinical benefits for the treatment of patients with HRPC: results of a randomized phase III trial // J Clin Oncology. 2007. ASCO Annual Meeting Proceedings Part I. Vol. 25. № 18S. Abstr. 5019.
- Eymard J., Oudard S., Gravis G. et al. Second-line chemotherapy with docetaxel (D) in men treated with docetaxel-based regimen for metastatic hormonerefractory prostate cancer (mHRPC). // ASCO Prostate Cancer Symp 2007. Abstr 249.
- Berthold D.R., Pond G., de Wit R., Eisenberger M., Tannock I.F.; TAX 327. Investigators. Survival and PSA response of patients in the TAX 327 study who crossed over to receive docetaxel after mitoxantrone or vice versa. // Ann Oncol. 2008. Vol. 19. № 10. P. 1749-1753.
- Nakabayashi M., Ling J., Xie W., Regan M.M., Oh W.K. Response to vinorelbine with or without estramustine as second-line chemotherapy in patients with hormone- refractory prostate cancer // Cancer J. 2007. Vol. 13. № 2. P. 125-129.
- Michels J., Montemurro T., Murray N., Kollmannsberger C., Nguyen Chi K. First and second-line chemotherapy with docetaxel or mitoxantrone in patients with hormone- refractory prostate cancer //Cancer. 2006. Vol. 106. № 5. P. 1041-1046.
- Oh W.K., Manola J., Babcic V., Harnam N., Kantoff P.W. Response to second-line chemotherapy in patients with hormone refractory prostate cancer receiving two sequences of mitoxantrone and taxanes. //Urology. 2006. Vol. 67. № 6. P. 1235-1240.
- Tannock I.F., Osoba D., Stockler M.R., Ernst D.S., Neville A.J., Moore M.J., Armitage G.R., Wilson J.J., Venner P.M., Coppin C.M., Murphy K.C. Chemotherapy with mi- toxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer: a Canadian randomized trial with palliative end points.// J Clin Oncol. 1996. Vol. 14. № 6. P. 1756-1764.
- Hartley-Asp B., Natale R.B., Dreicer R., Falcon S., Ricardez A., Redfern C. et al. Phase II study of weekly intravenous estramustine phosphate 2.000 mg/m2 in patients with hormone-refractory prostate cancer // Proc Am Soc Clin Oncol. 2001. 20. Abstr 183.
- Morote J., Lopez-Pacios M.A., Ahmad A., Vila J., De Torres J.A. Treatment of hormone-refractory prostate cancer with estramustine phosphate. //Actas Urol Esp. 1991. Vol. 15, N 5. P. 421-424.
- Hudes G., Einhorn L., Ross E., Balsham A., Loehrer P., Ramsey H., Sprandio J., Ent- macher M., Dugan W., Ansari R., Monaco F., Hanna M., Roth B.l. Vinblastine versus vinblastine plus oral estramustine phosphate for patients with hormonorrefractory prostate cancer: a Hoosier Oncology Group and Fox Chase Network phase III trial // J Clin Oncol. 1999. Vol. 17. № 10. P. 3160-3166.
- Sweeny C.J., Monaco F.J., Jung S.H., Wasielewsky M.Y., Picus J., Ansar R.H. A phase II Hoosier Oncology Group study of vinorelbine and estramustine phosphate in the hormone-refractory prostate cancer. // Ann Oncol. 2002. Vol. 13. № 3. P. 435-440.
- Huguet Perez J., Maroto Rey P., Palou Redorta J., Villavicencio Mavrich H. Hormone- refractory prostate cancer. Changes in therapeutic strategies since the utility of che- motherapy.// Actas Urol Esp. 2006. Vol. 30. № 2. 123-133.
- Yap R., Veliceasa D., Emmenegger U., Kerbel R.S., McKay L.M., Henkin J., Volp- ert O.V. Metronomic low-dose chemotherapy boosts CD95-dependent antiangiogen- ic effect of the thrombospondin peptide ABT-510: a complementation antiangiogenic strategy // Clin Cancer Res. 2005. Vol. 11. № 18. P. 6678-6685.
- Lord R., Nair S., Schache A., Spicer J., Somaihah N., Khoo V., Pandha H. Low dose metronomic oral cyclophosphamide for hormone resistant prostate cancer: a phase II study //J Urol. 2007. Vol.177. № 6. P. 2136-2140.
- Aragon-Ching J.B., Dahut W.L. About tyrosine kinase inhibitors (TKIs) in prostate cancer: where do we go from here? //Ann Oncol. 2010. Vol. 21, № 1. P. 183-184.
- Attard G., Sarker D., Reid A., Molife R., Parker C., Bono de J.S. Improving the outcome of patients with castration-resistant prostate cancer through rational drug development // Br J Cancer. 2006. Vol. 95. № 7. P. 767-774.
- Ortholan C., Durivault J., Hannoun-Levi J.M., Guyot M., Bourcier C., Ambrosetti D., Safe S., Pages G. Bevacizumab/docetaxel association is more efficient than docetaxel alone in reducing breast and prostate cancer cell growth: A new paradigm for understanding the therapeutic effect of combined treatment. //Eur J Cancer. 2010. Vol. 46. № 16. P. 3022-3036.
- Mitchell S.A., Danca M.D., Blomgren P.A., Darrow J.W., Currie K.S., Kropf J.E., Lee S.H., Gallion S.L., Xiong J.M., Pippin D.A., DeSimone R.W., Brittelli D.R., Eustice D.C., Bourret A., Hill-Drzewi M., Maciejewski P.M., Elkin L.L. Imidazo [1,2-a] pyrazine diaryl ureas: inhibitors of the receptor tyrosine kinase EphB4. // Bioorg Med Chem Lett. 2009. Volo. 19, N 24. P. 6991-6995.
- Singh R.P., Sharma G., Mallikarjuna G.U., Dhanalakshmi S., Agarwal C., Agarwal R. In vivo suppression of hormonerefractory prostate cancer growth by inositol hexa- phosphate: induction of insulinlike growth factor binding protein-3 and inhibition of vascular endothelial growth factor. //Clin Cancer Res. 2004. Vol. 10. № 1. Pt 1. P. 244-250.
- Takei Y., Kadomatsu K., Yuzawa Y., Matsuo S., Muramatsu T. A small interfering RNA targeting vascular endothelial growth factor as cancer therapeutics. // Cancer Res. 2004. Vol. 64. № 10. P. 3365-3370.
- Fox W.D., Higgins B., Maiese K.M., Drobnjak M., Cordon-Cardo C., Scher H.I., Agus D.B. Antibody to vascular endothelial growth factor slows growth of an androgen-independent xenograft model of prostate cancer. //Clin Cancer Res. 2002. Vol. 8, № 10. P. 3226-3231.
- Kohli M., Kaushal V., Spencer H.J., Mehta P. Prospective study of circulating angiogenic markers in prostate-specific antigen (PSA)-stable and PSAprogressive hormone-sensitive advanced prostate cancer. //Urology. 2003. Vol. 61. P. 765-769.
- Shariat S.F., Anwuri V.A., Lamb D.J., Shah N.V., Wheeler T.M., Slawin K.M. Association of preoperative plasma levels of vascular endothelial growth factor and soluble vascular cell adhesion molecule-1 with lymph node status and biochemical progression after radical prostatectomy //J Clin Oncol. 2004. Vol. 22, № 9. P. 1655-1663.
- George D.J., Regan M.M., Oh W.K., Tay M.H., Manola J., Decalo N., Duggan S., Dewolf W.C., Kantoff P.W., Bubley G.J. Radical prostatectomy lowers plasma vascular endothelial growth factor levels in in patients with prostate cancer // Urology. 2004. Vol. 63. № 2. P. 327-332.
- Mendel D.B., Laird, A.D., Xin X., Louie S.G., Christensen J.G., Li G., Schreck R.E., Abrams T.J., Ngai T.J., Lee L.B., Murray L.J., Carver J., Chan E., Moss K.G., Hazne- dar J.O., Sukbuntherng J., Blake R.A., Sun L., Tang C., Miller T., Shirazian S., McMahon G., Cherrington J.M. In vivo antitumor activity of SU11248, a novel tyrosine kinase inhibitor targeting vascular endothelial growth factor and platelet-derived growth factor receptors: determination of a pharmacokinetic / pharmacodynamic relationship. // Clin Cancer Res. 2003. Vol. 9. № 1. P. 327-337.
- O’Farrell A.M., Abrams T.J., Yuen H.A., Ngai T.J., Louie S.G., Yee K.W., Wong L.M., Hong W., Lee L.B., Town A., Smolich B.D., Manning W.C., Murray L.J., Heinrich M.C., Cherrington J.M.. SU11248 is a novel FLT3 tyrosine kinase inhibitor with potent activity in vitro and in vivo // Blood. 2003. Vol. 101. № 9. P. 3597-3605.
- Fokt R.M., Templeton A., Gillessen S., Ohlschlegel C., Schmid H.P. Prostatic metastasis of renal cell carcinoma successfully treated with sunitinib. // Urol Int. 2009. Vol. 83. № 1. P. 122-124.
- Cumashi A., Tinari N., Rossi C., Lattanzio R., Natoli C., Piantelli M., Iacobelli S. Cancer Lett. Sunitinib malate (SU-11248) alone or in combination with low-dose docetaxel inhibits the growth of DU-145 prostate cancer xenografts // Cancer Lett. 2007.Vol. 270. № 2. P. 229-233.
- Dror Michaelson M., Regan M.M., Oh W.K., Kaufman D.S., Olivier K., Michaelson S.Z., Spicer B., Gurski C., Kantoff P.W., Smith M.R. Phase II study of sunitinib in men with advanced prostate cancer. // Ann Oncol. 2009. Vol. 20, № 5. P. 913-920.
- Sonpavde G., Periman P.O., Bernold D., Weckstein D., Fleming M.T., Galsky M.D., Berry W.R., Zhan F., Boehm K.A., Asmar L., Hutson T.E. Sunitinib malate for metastatic castration-resistant prostate cancer following docetaxel-based chemotherapy. // Ann Oncol. 2010. Vol. 21. № 2. P. 319-324.
- https://www.clinicaltrials.gov/ct2/show/NCT00945477?term=pazopanib&rank=21
- https://www.clinicaltrials.gov/ct2/show/NCT00454571?term=pazopanib&rank=86
- https://www.clinicaltrials.gov/ct2/show/NCT01385228?term=pazopanib&rank=3
| Прикрепленный файл | Размер |
| 702.34 кб |
Плюсы лечения
Самым основным преимуществом таргетной терапии являются целевые лекарства. Они целенаправленно уничтожают злокачественное образование, при этом не затрагивая здоровые клеточные структуры. К плюсам целевого лечения можно отнести:
- таблетированную форму препаратов;
- минимум побочных проявлений;
- легкую переносимость;
- отсутствие противопоказаний в комплексе с иными методиками;
- прицельно направленное воздействие на раковые клетки.
По теме
- Лечение
Как влияет лучевая терапия на организм
- Наталья Геннадьевна Буцык
- 4 декабря 2020 г.
Прием лекарств допустим в домашних условиях. Терапия не отражается на работоспособности пациента.
К преимуществу целевой терапии рака почки относится разносторонний принцип действия медикаментов. Первая группа воздействует на замедление роста и метастазов, вторая ─ разрушает иммунные клеточные структуры, третья ─ дезориентирует онко клетки.
Преимущества таргетной терапии при раке почки
Главный недостаток классической химиотерапии в том, что химиопрепараты атакуют не только раковые, но и здоровые клетки, если они активно размножаются. В первую очередь страдают: красный костный мозг, кожа и волосяные фолликулы, слизистые оболочки. Таргетные препараты действуют прицельно, поэтому у них меньше побочных эффектов, они менее выражены. Тяжелые осложнения встречаются редко.
При этом таргетные препараты зачастую эффективны там, где классические химиопрепараты не справляются. Благодаря им лечение рака почки и других органов на поздних стадиях стало более эффективным. Пусть таких пациентов до сих пор чаще всего невозможно вылечить, но таргетная терапия помогает продлевать жизнь. Если удалось подарить онкобольному хотя бы еще один день — это уже победа. На практике зачастую речь идет о более существенных сроках.
Побочные эффекты
Все лекарственные средства имеют нежелательные побочные проявления. Целевая терапия не исключение. Пациент может наблюдать умеренную головную боль, усталость, сухость ротовой полости, раздражение кожного покрова, тонкость и ломкость волос. Иногда случаются более тяжелые отклонения:
- нарушение стула;
- рвота;
- зуд и высыпания на коже ладоней и стоп;
- выпадение волос;
- частые скачки давления;
- хрипота голоса.
Справиться с побочными эффектами поможет врач.